
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1) 用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的 活性炭和NO,发生 反应C(s)+2NO(g) ![]() N2(g)+CO2(g)△H=QkJ/mol。 在T1℃时,反应进行到不同时间(min) 测得各物质的浓度(mol/L) 如下:
N2(g)+CO2(g)△H=QkJ/mol。 在T1℃时,反应进行到不同时间(min) 测得各物质的浓度(mol/L) 如下:
浓度 时间 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①30min 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是________(填字母编号)
a.通入一定量的NO b.加入定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
② 若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3: 1: 1,则Q_____ 0 (填“>”或“<”<)。
(2) 某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,则得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,利用以下反应:NO+CO![]() N2+CO2( 有CO) 2NO
N2+CO2( 有CO) 2NO![]() N2+ O2 (无CO)
N2+ O2 (无CO)

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为: __________;在n(NO)/n(CO)= 1的条件下,应控制最佳温度在_______左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染,写出C2H6与NO2发生反应的化学方程式_________________。
③以NO2、O2 熔融NaNO3
(3) 天然气的一个重要用途是制取氢气,其原理如下:

已知:① 2CO(g)+O2(g)=2CO2(g) △H1
②CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) △H2
③2H2(g)+O2(g)=2H2O(l) △H3
1)科学家提出一种利用天然气制备氢气的方法: CH4(g)+ CO2(g)=2CO(g)+2H2(g) △H=_____
2)这种方法的推广与使用,不仅实现资源综合利用,而且还能解决环境问题是_________。
【答案】 ad < 该反应是放热反应,升高温度反应更有利于向逆反应方向进行 870℃ (850℃到900℃之间都可以) 4C2H6+ 14NO2![]() 8CO2+7N2+12H2O NO2+ NO3--e-=N2O5 △H=△H2-△H1-△H3 减少温室气体排放,缓解温室效应
8CO2+7N2+12H2O NO2+ NO3--e-=N2O5 △H=△H2-△H1-△H3 减少温室气体排放,缓解温室效应
【解析】试题分析:本题考查图像和图表的分析,外界条件对化学平衡的影响,化学方程式的书写,盖斯定律的应用,原电池原理和电极反应式的书写。
(1)①根据表格20min和30min时各物质的浓度分别对应相等,20min时已经达到平衡;40min和50min时各物质的浓度分别对应相等,40min时又再次达到平衡;30min时改变条件,达到新平衡时NO浓度增大为原来的0.60![]() 0.50=1.2倍,N2和CO2的浓度增大为原来的0.3
0.50=1.2倍,N2和CO2的浓度增大为原来的0.3![]() 0.25=1.2倍。a项,通入一定量NO,平衡正向移动,达到新平衡时NO、N2、CO2的浓度都可能为原来的1.2倍(由于C为固体,相当于增大压强平衡不移动);b项,加入定量活性炭,平衡不移动,各物质物质的量浓度不变;c项,加入合适催化剂,加快反应速率,平衡不移动,各物质物质的量浓度不变;d项,适当缩小容器体积,平衡不移动,由于体积减小,达到新平衡时NO、N2、CO2的浓度都可能为原来的1.2倍;30min改变的条件可能是通入一定量的NO、适当缩小容器的体积,答案选ad。
0.25=1.2倍。a项,通入一定量NO,平衡正向移动,达到新平衡时NO、N2、CO2的浓度都可能为原来的1.2倍(由于C为固体,相当于增大压强平衡不移动);b项,加入定量活性炭,平衡不移动,各物质物质的量浓度不变;c项,加入合适催化剂,加快反应速率,平衡不移动,各物质物质的量浓度不变;d项,适当缩小容器体积,平衡不移动,由于体积减小,达到新平衡时NO、N2、CO2的浓度都可能为原来的1.2倍;30min改变的条件可能是通入一定量的NO、适当缩小容器的体积,答案选ad。
②30min时容器中NO、N2、CO2的浓度之比为0.50:0.25:0.25=2:1:1,升高温度达到平衡时容器中NO、N2、CO2的浓度之比为3:1:1,升高温度平衡向逆反应方向移动,逆反应为吸热反应,正反应为放热反应,Q![]() 0。
0。
(2)①若不使用催化剂,发生的反应为2NO![]() N2+O2,温度超过775℃,NO的分解率降低,可能原因是:该反应是放热反应,升高温度更有利于反应向逆反应方向进行。根据图像当n(NO)/n(CO)=1时,870℃左右NO的转化率最大,所以应控制的最佳温度在870℃左右。
N2+O2,温度超过775℃,NO的分解率降低,可能原因是:该反应是放热反应,升高温度更有利于反应向逆反应方向进行。根据图像当n(NO)/n(CO)=1时,870℃左右NO的转化率最大,所以应控制的最佳温度在870℃左右。
②烃催化还原NOx可消除氮氧化物的污染,氮氧化物被还原为N2,则烃转化成CO2和H2O,C2H6与NO2反应的化学方程式为4C2H6+14NO2![]() 8CO2+12H2O+7N2。
8CO2+12H2O+7N2。
③石墨II通入O2,石墨II为正极,石墨I为负极,Y是一种氧化物,NO2发生氧化反应生成Y,Y为N2O5,电极反应式为NO2-e-+NO3-=N2O5。
(3)应用盖斯定律,将②-①-③得,CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=ΔH2-ΔH1-ΔH3。这种方法的推广与使用,不仅实现资源综合利用,而且还能解决的环境问题是:减少温室气体的排放,缓解温室效应。


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:

下列说法正确的是
A. 分离器中的物质分离操作为过滤
B. 膜反应器中,增大压强有利于提高HI的分解速率和平衡转化率
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+I2 == H2+2H2SO4+ 2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是( )
A.p(Ne)>p(H2)>p(O2)
B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne)
D.p(H2)>p(Ne)>p(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.同分异构体由于结构不同,所以化学性质一定不相似
B.同系物一定同类,且电子数之差一定为8的整数倍
C.凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物
D.两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 分子中共价键键能越高,键长越长,则分子越稳定
B. 元素周期表中的ⅡA族和ⅦA族元素的原子间不能形成共价键
C. 水分子可表示为H—O—H,分子中键角为180°
D. N—N、N===N、N≡N键能之比为1.00:2.17:4.90,说明N2分子中π键键能>σ键键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)饱和一元醇的相对分子质量为88,它有多种同分异构体,其中不能发生催化氧化反应的结构简式为:;不能发生消去反应的结构简式为:;
(2)“智能型”大分子在生物工程中有广泛的应用前景.PMAA就是一种“智能型”大分子,可用于生物制药中大分子与小分子的分离,下列是以物质A为起始反应物合成PMAA的路线.
根据上述过程回答下列问题:
①写出结构简式:A PMAA
②写出上述过程中的反应类型:①④
③写出③的化学方程式
④写出E在一定条件下形成有机高分子的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在同一溶液中大量共存的是
A.Ba2+、Na+、、Cl-、SO42-B.H+、K+、NO3-、CO32-
C.H+、Cu2+、、Cl-、SO42-D.Ag+ 、Na+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是H2S和SO2)的转化具有重要意义。
(1)H2S资源化利用途径之一是回收能量并得到单质硫,如图为质子膜H2S燃料电池的示意图。
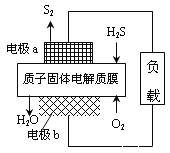
①电极a为电池的_______极,电极b上发生的电极反应为:______________________。
②每17gH2S参与反应,有_____molH+经质子膜进入_____极区。
(2)低浓度SO2废气的处理是工业难题,目前常用的方法如下:
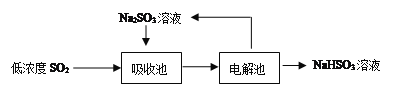
①Na2SO3溶液吸收SO2的化学方程式是____________________________________。
②如果用含等物质的量溶质的下列各溶液分别吸收SO2,则理论吸收量最多的是(____)
A.Na2SO3B.Na2S C.Ba(NO3)2 D.酸性KMnO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com