
| A. | 吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒 | |
| B. | 移液管放液时,将移液管稍倾斜放入直立的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 | |
| C. | 生物体死亡后,体内含有的碳-14会逐渐减少,因此可通过测量生物体遗骸中碳-14的含量,来计算它存活的年代.碳-14减少的变化为化学变化 | |
| D. | 当用电解法除去溶液中的Cr2O72-离子时,因其具有强氧化性易得电子,故可在阴极直接放电生成Cr3+,最后生成Cr(OH)3沉淀除去 |
分析 A.酒精和乙醚具有麻醉作用,减弱对呼吸道的刺激,减轻咳嗽;
B.移液管放液时,移液管不能接触容器内壁;
C.碳-14减少时没有新物质生成;
D.电解时,阴离子向阳极移动.
解答 解:A.酒精和乙醚具有麻醉作用,减弱对呼吸道的刺激,减轻咳嗽,则实验室中吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒,故A正确;
B.移液管放液时,移液管不能接触容器内壁,否则会污染溶液,故B错误;
C.碳-14减少时没有新物质生成,所以不是化学变化,故C错误;
D.电解时,阴离子向阳极移动,所以Cr2O72-离子向阳极移动,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及实验安全、基本操作、电解原理等知识点,综合性较强,侧重考查基本原理和基本操作,明确实验原理是解本题关键,易错选项是D.


科目:高中化学 来源: 题型:解答题
 .
.| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对. |
| B | 铝箔在酒精灯火焰上加热融化但不滴落 | 铝箔对熔化的铝有较强的吸附作用 | Ⅰ对;Ⅱ错. |
| C | 铝粉可以和氧化铁粉末发生铝热反应 | 铝热反应是工业炼铁最常用方法 | Ⅰ对;Ⅱ错. |
| D | 铜在潮湿空气中表面会生成铜绿 | 可用铜容器盛放浓硫酸 | Ⅰ对;Ⅱ对. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 常温常压下,7.0g乙烯与丙稀的混合物中含有氢原子的数目为NA | |
| C. | 50mL18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向能使PH试纸显深蓝色的溶液中通入少量二氧化碳:OH-+CO2═HCO3- | |
| B. | 向NaClO溶液中加入浓氢溴酸:ClO-+2H++2 Br-═Cl-+Br2+H2O | |
| C. | 向NaClO溶液中通入少量二氧化碳:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 向FeBr2溶液中滴加少量HClO溶液:2Fe2++HClO═2Fe3++Cl-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
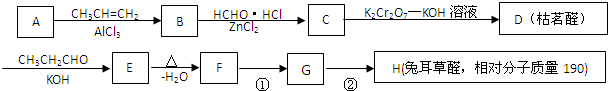
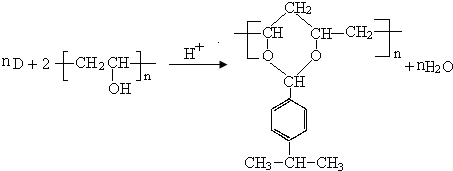
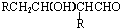 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$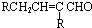
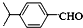 .
.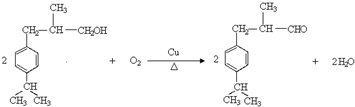 .
.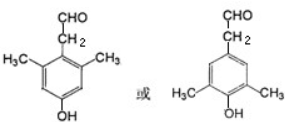 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
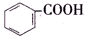 >H2CO3>
>H2CO3>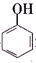 >HCO${\;}_{3}^{-}$,现将
>HCO${\;}_{3}^{-}$,现将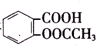 转变为
转变为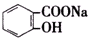 ,可行的方法是( )
,可行的方法是( )| A. | 向该溶液中加入足量的稀硫酸,加热 | |
| B. | 将该物质与稀硫酸共热后,再加入足量的NaOH溶液 | |
| C. | 将该物质与稀硫酸共热后,再加入足量的Na2CO3溶液 | |
| D. | 将该物质与足量的NaOH溶液共热,再通入足量CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,使煤和氢气作用,可以得到液体燃料,也可以获得洁净的燃料油 | |
| B. | (CH3)2CHCH(CH3)2的系统命名为:2,3-二甲基丁烷 | |
| C. | 硬脂酸甘油酯可以在稀硫酸中水解,也可以在NaOH溶液中发生皂化反应彻底水解 | |
| D. | 氨基酸分子中均含有氨基和羧基,加入浓的硫酸钠溶液可从溶液中析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木糖醇与核糖(C3H10O3)互为同分异构体 | |
| B. | 木糖醇与甘油(CH2OHCHOHCH2OH)互为同系物 | |
| C. | 木糖醇可以与乙酸发生酯化反应 | |
| D. | 木糖醇与葡萄一样是一种单糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com