
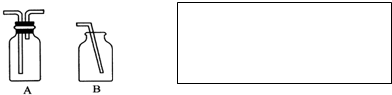
科目:高中化学 来源: 题型:选择题
| A. | 苯的硝化反应是取代反应 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡并静置后下层液体为紫色 | |
| C. | 78g苯(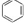 )中含有C=C双键的数目为3NA )中含有C=C双键的数目为3NA | |
| D. | 在一定条件下,苯能与氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaOH固体,平衡正向移动,溶液中c(H+)增大 | |
| B. | 加水,平衡正向移动,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| C. | 通入少量HCl,平衡逆向移动,溶液中c(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡逆向移动,溶液导电能力减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何一个氧化还原反应都可以设计为原电池,输出电能 | |
| B. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合后溶液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 任何可逆反应,其平衡常数越大,反应速率、反应物的转化率越大 | |
| D. | pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水、双氧水、水玻璃都是纯净物 | B. | 乙醚和乙醇互为同分异构体 | ||
| C. | 乙醇、氯气、葡萄糖都是非电解质 | D. | 甲酸与硬脂酸属于同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
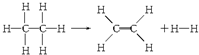
| A. | 该反应放出251.2 kJ的热量 | B. | 该反应吸收251.2 kJ的热量 | ||
| C. | 该反应放出125.6 kJ的热量 | D. | 该反应吸收125.6 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
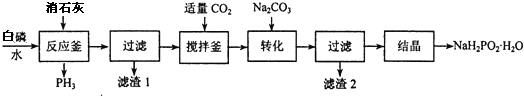
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com