
����Ŀ�����г����µ�������Һ����0.01molL��1 CH3COOH��Һ����0.01molL��1 HCl��Һ����pH=12�İ�ˮ����pH=12��NaOH��Һ����0.01molL��1 CH3COOH��Һ��pH=12�İ�ˮ�������Ϻ�������Һ����0.01molL��1 HCl��Һ��pH=12��NaOH��Һ��������������Һ��
��1������ˮ�ĵ���̶�������__________������ţ���ͬ����ˮ�ĵ���̶���ͬ����_____________________��
��2�������ڢۻ�Ϻ�������Һ��pH=7����������Һ���������_____�ۣ�������������������=������
��3����������Һͬ��ϡ��10������Һ��pH����_____������_____������_____�ޣ�������������������=������
��4�����٢ܻ�ϣ�����c��CH3COO������c��H+����������Һ���ܳ�___________������ţ���
A������ B������ C�����ԣ�
���𰸡��� �ڢۢ� �� �� �� �� ABC
��������
��1��ˮ����������ʣ����ڵ���ƽ��H2O![]() H����OH�������ݵ���������ӿ�֪����������ˮ�ĵ��룬�������ˮ�����Ǵٽ�ˮ�ĵ��롣pH=12�İ�ˮ��˵����ˮ��Ũ�ȴ���0.01mol/L���������а�ˮ�ǹ����ģ�������Һ�Լ��ԡ������ж���ǡ�÷�Ӧ�����Ȼ��ƣ��Ȼ����Dz��ܷ���ˮ��ģ������ڸ���Һ��ˮ�ĵ���û�б����ƣ������٢ڢۢܢ��о�������ˮ�ĵ���ġ���Ϊ�ڢۢ���H��Ũ�Ȼ�OH����Ũ�Ⱦ���0.01mol�����Զ�ˮ�ĵ������Ƴ̶�����ͬ�ġ�
H����OH�������ݵ���������ӿ�֪����������ˮ�ĵ��룬�������ˮ�����Ǵٽ�ˮ�ĵ��롣pH=12�İ�ˮ��˵����ˮ��Ũ�ȴ���0.01mol/L���������а�ˮ�ǹ����ģ�������Һ�Լ��ԡ������ж���ǡ�÷�Ӧ�����Ȼ��ƣ��Ȼ����Dz��ܷ���ˮ��ģ������ڸ���Һ��ˮ�ĵ���û�б����ƣ������٢ڢۢܢ��о�������ˮ�ĵ���ġ���Ϊ�ڢۢ���H��Ũ�Ȼ�OH����Ũ�Ⱦ���0.01mol�����Զ�ˮ�ĵ������Ƴ̶�����ͬ�ġ�
��2����pH=12�İ�ˮ��˵����ˮ��Ũ�ȴ���0.01mol/L�������ڢ��������Ϻ�ˮ��������Һ�Լ��ԣ�Ҫʹ��Һ�����ԣ���������������ڰ�ˮ�������
��3�����������ϡ�������Ǵٽ�����ģ������ӵ����ʵ��������ӵġ���ǿ���������Һ�в����ڵ���ƽ�⣬���ϡ��ʱ���ӵ����ʵ����Dz���ġ��٢�ϡ����ͬ��������ߵ�Ũ����Ȼ��ȣ�����pHǰ�ߴ��ۢ�ϡ��ǰpH��ȣ���ϡ�ͺ�����OH�������ʵ���Ҫ�������еģ�����pH��ǰ�ߴ�ϡ��ǰ���Լ��ԣ��������ԣ�����ϡ�ͺ���Ȼ��ǰ�ߵ�pH��
��4���٢���Ϻ��ݵ���غ��֪c(H��)��c(Na��)��c(OH��)��c(CH3COO��)����c(CH3COO��)��c(H��)����c(Na��)��c(OH��)����c(H����c(OH��)�Ĵ�С��ϵ��ȷ�������Ը���Һ���������ԡ����Ի����ԡ�


 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��M��ԭ��������������Ԫ��X��һ�ָ�Ӳ�ȵ����DZ�ʯ��Y2+ ���Ӳ�ṹ������ͬ��Z��������Ϊż����������M����Ϊ����ɫ���壬�ش��������⣺
(1)MԪ��λ�����ڱ��еĵ�________ ����________ �壮
(2)ZԪ�صķ����� ________ ��������Ȼ���г����Ķ�Ԫ��������________ (д��ѧʽ) ��
(3)X��M�ĵ����ڸ����·�Ӧ�Ļ�ѧ����ʽΪ________���������Ϊֱ���Σ��仯ѧ����___ ���ۼ�(���������������Ǽ�����)��
(4)����Ԫ���е�________(д����) �����ں��պ���Ͻ���ϵ��Ʊ����䵥����ϡ���ᷴӦ�Ļ�ѧ����ʽΪ________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ȼ����Ϊ890.3 kJmol��1��������ȼ����Ϊ285.8 kJmol��1������9 mol�ļ���������Ļ�����壬��ȫȼ�պ�ų�����7408.2 kJ����û�������м�������������ʵ�����Ϊ(����)
A. 1��8 B. 8��1 C. 4��17 D. 17��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ��������Ӧ2HI��g��![]() H2��g��+I2��g���������������ȵĺ����ܱ�����A��B��C�У��ֱ�����2mol HI����3mol HI����1mol H2��1mo1I2���ֱ��ƽ��ʱ�����¹�ϵ��ȷ����
H2��g��+I2��g���������������ȵĺ����ܱ�����A��B��C�У��ֱ�����2mol HI����3mol HI����1mol H2��1mo1I2���ֱ��ƽ��ʱ�����¹�ϵ��ȷ����
A. ƽ��ʱ����������ѹǿ����=��=��
B. ƽ��ʱ��I2��Ũ�ȣ��ڣ���=��
C. ƽ��ʱ��I2������������ڣ���=��
D. �ӷ�Ӧ��ʼ����ƽ���ʱ�䣺�٣���=��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������Ͷ�������������Լ���(����)
A.���۵⻯����ҺB.�Ȼ�������Һ
C.��������ҺD.����������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Һ����������й©�������������зdz��õĴ���Ч�������������ܷ�����Ӧ��Na2S2O3+4Cl2+5H2O=2NaCl+6HCl+2H2SO4������˵����������� ��
A. Na2S2O3�ڸ÷�Ӧ������ԭ��
B. ��������ʱ��Na2S2O3����ʱ�����������Һ�л���ֻ��ǵ�����
C. 1molNa2S2O3��������ȫ��Ӧת�Ƶ���4mol
D. ���������뻹ԭ��������ʵ���֮��Ϊ1��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ϳɰ����Ȼ�ѧ����ʽΪ��N2��g��+ 3H2��g��![]() 2NH3��g����H=��92kJ/mol,����˵������ȷ����
2NH3��g����H=��92kJ/mol,����˵������ȷ����
A. ��1molN2��3molH2��ַ�Ӧ���ɷų�92kJ����
B. ���ݺ��·����÷�Ӧʱ���������г�������He����Ӧ���ʼӿ���ƽ�������ƶ�
C. ��ѹ���·����÷�Ӧʱ���������г�������He����Ӧ���ʲ�����ƽ�ⲻ�ƶ�
D. �����¶�ʱ�������淴Ӧ���ʶ��ӿ죬���淴Ӧ�������Ӹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������һ����Ҫ�Ļ���ԭ�ϣ�ͨ���úϳɰ����ϳ�����IJ����������
��1�������ˮ��ҺpH__________7��������������=����������������ˮ��Һ�и�������Ũ�ȴ�С��ϵΪ___________
��2����֪�ϳɰ����Ȼ�ѧ����ʽΪ��N2��g��+ 3H2��g��![]() 2NH3��g����H=��92kJ/mol�����յ��������������ʵ���֮��1��3�ı������ֱ���200�桢400�桢600���������½��з�Ӧ��������NH3�����ʵ���������ѹǿ�ı仯������ͼ��ʾ
2NH3��g����H=��92kJ/mol�����յ��������������ʵ���֮��1��3�ı������ֱ���200�桢400�桢600���������½��з�Ӧ��������NH3�����ʵ���������ѹǿ�ı仯������ͼ��ʾ
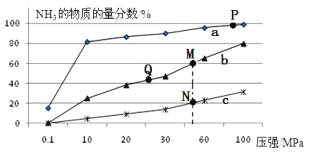
������c��Ӧ���¶�Ϊ___________ ��
������˵������ȷ����___________
A����������Ũ�ȣ��ɴٽ�ƽ�������ƶ�������ߵ�����ת����
B��Q���Ӧ�ķ�Ӧ�����£��������ʵ��Ĵ����������NH3�ڻ�����е����ʵ�������
C��M��N�����ƽ�ⳣ����С��ϵΪ��M��N
D��M��N��Q���㷴Ӧ���ʵĴ�С��ϵΪ��N��M��Q
E��Ϊ�˾����ܶ�ĵõ�NH3��Ӧ��ѡ��P���Ӧ���¶Ⱥ�ѹǿ��Ϊ��������
��3������[CO(NH2)2]��һ�ַdz���Ҫ�ĸ�Ч���ʣ���ҵ����NH3��CO2Ϊԭ���������أ��÷�Ӧʵ��Ϊ������Ӧ��
��һ����2NH3(g)��CO2(g)=H2NCOONH4(s) ��H=��272kJ��mol��1
�ڶ�����H2NCOONH4(s)=CO(NH2)2(s)��H2O(g) ��H=��138kJ��mol��1
д����ҵ����NH3��CO2Ϊԭ�Ϻϳ����ص��Ȼ�ѧ����ʽ��_________________________
��4����������β��������ͨ����������Ϊ��������β�������ռ����������Ϊ������Ⱦ�ij������ʣ���д��������NO��Ӧ�Ļ�ѧ����ʽ__________������1mol������ȫ��Ӧʱ��ת�Ƶ��ӵ���ĿΪ___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȲΪ��Ҫԭ�Ͽ��Ժϳɾ�����ϩ���۱�ϩ����ȶ�����ͼ��ʾ���йغϳ�·��ͼ��
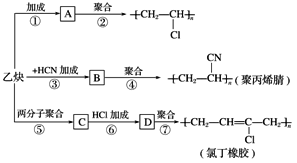
��֪��Ӧ��
nCH2===CH��CH===CH2![]()
![]()
��������и��⣺
(1)д���������ʵĽṹ��ʽ��
A________________��C________________��
(2)д�����з�Ӧ�Ļ�ѧ����ʽ��
��Ӧ��________________________________________________________________________��
��Ӧ��________________________________________________________________________��
��Ӧ��________________________________________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com