
 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH1=-99 kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH1=-99 kJ·mol-1


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 放出942kJ热量。由此判断下列说法正确的是( )
放出942kJ热量。由此判断下列说法正确的是( )
| A.N4属于一种新型的化合物 | B.N4与N2互为同素异形体 |
| C.N4沸点比P4(白磷)高 | D.1molN4转变为N2将放出1216kJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应物总能量为679kJ |
| B.生成物总能量为431kJ |
| C.氢气和氯气反应生成2 mol氯化氢气体,反应放出183 kJ·mol-1能量 |
| D.氢气和氯气反应生成2 mol氯化氢气体,反应吸收183 kJ·mol-1能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.已知2H2(g)+O2(g)=2H2O(l) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为483.6 kJ·mol-1 |
| B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.已知2C(s)+2O2(g)=2CO2(g) ΔH1 2C(s)+O2(g)=2CO(g) ΔH2 则ΔH1>ΔH2 |
| D.已知Ni(CO)4(s)=Ni(s)+4CO(g) ΔH=+Q kJ·mol-1,则Ni(s)+4CO(g)=Ni(CO)4(s) ΔH=-Q kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
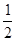 O2(g) = H2O(g) ΔH1=a kJ·mol-1?
O2(g) = H2O(g) ΔH1=a kJ·mol-1?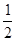 O2(g) = H2O(l) ΔH2=b kJ·mol-1??
O2(g) = H2O(l) ΔH2=b kJ·mol-1??| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值: (写出 + 或-)。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值: (写出 + 或-)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.△H=-1141.8 kJ·mol-1 | B.△H=+260.4kJ·mol-1 |
| C.△H=+441.8 kJ·mol-1 | D.△H=-260.4 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.吸热反应 | B.放热反应 | C.放出832 kJ热量 | D.吸收183 kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com