
| A. | c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl) | |
| B. | 室温下若0.3mol•L-1HY溶液与0.3mol•L-1NaOH溶液等体积混合后,溶液的pH=9,则c(OH-)-c(HY)=c(H+)=1×10-9mol•L-1 | |
| C. | 室温下0.2mol•L-1HCl溶液与等体积0.05mol•L-1Ba(OH)2溶液混合后,溶液的pH=1 | |
| D. | NaHCO3溶液中:c(OH-)═c(H+)+c(H2CO3)+c(HCO3-) |
分析 A.相同温度、相同浓度的这两种盐溶液,亚铁离子抑制铵根离子水解、铵根离子水解程度越大,则溶液中铵根离子浓度越小,溶质浓度越大;
B.二者恰好反应生成NaY,溶液呈碱性,则Y为弱酸,根据电荷守恒和物料守恒判断;
C.二者混合后溶液中的溶质是0.2mol/L的盐酸、0.05mol/L的Ba(OH)2,溶液中c(H+)=0.05mol/L;
D.碳酸氢钠溶液中,碳酸氢根离子的水解程度较小,则c(OH-)<c(HCO3-).
解答 解:A.相同温度、相同浓度的这3种盐溶液,亚铁离子抑制铵根离子水解,铵根离子水解程度越大,则溶液中铵根离子浓度越小,NH4+浓度相等的(NH4)2SO4、NH4Fe(SO4)2的溶液中溶质浓度大小顺序是(NH4)2SO4>NH4Fe(SO4)2,氯化铵的化学式中含有1个铵根离子,则NH4+浓度相等时氯化铵的浓度最大,所以溶质浓度大小为:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl),故A正确;
B.两溶液恰好反应产物为NaY,水解溶液呈碱性,电荷守恒为c(OH-)+c(Y+)=c(H+)+c(Na+);物料守恒为c(HY)+c(Y+)=c(Na+),两式相减为c(OH-)-c(HY)=c(H+)=1×10-9 mol•L-1,故B正确;
C.室温下0.2mol•L-1HCl溶液与等体积0.05mol•L-1Ba(OH)2溶液混合后,溶液中氢离子浓度为:c(H+)=$\frac{0.2mol/L-0.1mol/L}{2}$=0.05mol/L,溶液的pH>1,故C错误;
D.碳酸氢钠溶液中,由于碳酸氢根离子的水解程度较小,则c(OH-)<c(HCO3-),故D错误;
故选AB.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及盐的水解原理、酸碱混合的定性判断及溶液pH的计算、离子浓度大小比较等知识,注意掌握电荷守恒、物料守恒的含义及应用方法.


科目:高中化学 来源: 题型:选择题
| A. | 将人群向高处疏散 | |
| B. | 将人群向顺风方向疏散 | |
| C. | 用浸有水或肥皂水(弱碱性)的毛巾捂住口鼻 | |
| D. | 向泄漏地点撒一些石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60mL 1mol•L-1氯化钠溶液 | B. | 75mL 1mol•L-1氯化钙溶液 | ||
| C. | 60mL 3mol•L-1氯化钾溶液 | D. | 75mL 1.5mol•L-1氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
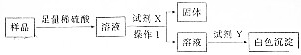
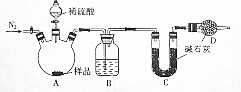
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:0.4mol液态N2H4与足量的液体双氧水反应,生成氮气和水蒸气,放出200.0kJ的热量.
已知:0.4mol液态N2H4与足量的液体双氧水反应,生成氮气和水蒸气,放出200.0kJ的热量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、NO${\;}_{3}^{-}$、Ag+ | B. | H+、HCO${\;}_{3}^{-}$、Na+、Cl- | ||
| C. | Na+、OH-、Ca2+、CO${\;}_{3}^{2-}$ | D. | Mg2+、Cl-、H+、SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、K+、Cl-、HCO3- | B. | K+、Ba2+、OH-、NO3- | ||
| C. | Mg2+、Cu2+、Cl-、SO42- | D. | Na+、Cl-、Ba2+、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
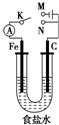
| A. | 若电键K与N连接,铁被保护不会腐蚀 | |
| B. | 若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 | |
| C. | 若电键K与N连接,正极反应式是 4OH--4e-═2H2O+O2↑ | |
| D. | 若电键K与M连接,当两极共产生22.4L(标准状况)气体时,生成了1mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
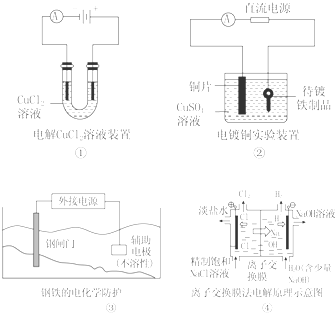
| A. | ①中阴极处能产生使湿润淀粉KI试纸变蓝的气体 | |
| B. | ②中待镀铁制品应与电源正极相连 | |
| C. | ③中钢闸门应与外接电源的正极相连 | |
| D. | ④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com