
分析 有A、B、C、D、E五种元素,A原子最外层p能级的电子数等于次外层的电子总数,p能级电子数不超过6,故原子只能有2个电子层,核外电子排布为1s22s22p2,故A为碳元素;A、B、C属于同一周期,B元素可分别与A、C、D、E生成RB2型化合物,B应为O元素,C为N元素;在DB2和EB2中,D与B的质量比为7:8,则有Mr(D):Mr(O)=7:4,故M(D)=7×$\frac{16}{4}$=28,D应为Si元素;E与B的质量比为1:1,则Mr(E)=2M(O)=2×16=32,所以E为S元素,据此解答.
解答 解:有A、B、C、D、E五种元素,A原子最外层p能级的电子数等于次外层的电子总数,p能级电子数不超过6,故原子只能有2个电子层,核外电子排布为1s22s22p2,故A为碳元素;A、B、C属于同一周期,B元素可分别与A、C、D、E生成RB2型化合物,B应为O元素,C为N元素;在DB2和EB2中,D与B的质量比为7:8,则有Mr(D):Mr(O)=7:4,故M(D)=7×$\frac{16}{4}$=28,D应为Si元素;E与B的质量比为1:1,则Mr(E)=2M(O)=2×16=32,所以E为S元素.
(1)由上述分析可知,D为Si元素,故答案为:Si;
(2)D为Si元素,价电子排布式为3s23p2,故答案为:3s23p2;
(3)碳在氧气中完全燃烧生成二氧化碳,反应方程式为:C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,故答案为:C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2;
(4)E为S元素,处于周期表中第三周期ⅥA族,故答案为:第三周期ⅥA族;
(5)同周期随原子序数增大,第一电离能呈增大趋势,由于N原子2p轨道为半充满状态,能量较低,第一电离能高于同周期相邻元素,所以第一电离能N>O>C,故答案为:N>O>C;
(6)Si、S同周期,随原子序数增大,电负性增大,故电负性Si<S,故答案为:Si<S.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意理解掌握同周期元素第一电离能异常情况.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:解答题
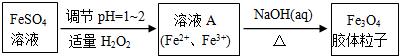
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 TiO2在光照射下可使水电解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$在2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水电解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$在2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | 该装置可以将光能转化为电能,同时也能转化为化学能 | |
| B. | 铂电极上发生的反应为:H2-2e-=2H+ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
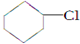 (一氯环己烷)$→_{△②}^{NaOH、乙醇}$
(一氯环己烷)$→_{△②}^{NaOH、乙醇}$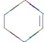 $→_{③}^{Br_{2}的CCl_{4}溶液}$B $\stackrel{④}{→}$
$→_{③}^{Br_{2}的CCl_{4}溶液}$B $\stackrel{④}{→}$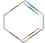
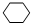 ,名称是环己烷.
,名称是环己烷.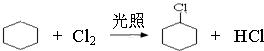 、
、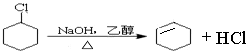 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
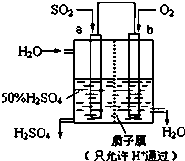
| A. | a为负极,b为正极 | |
| B. | b电极发生氧化反应 | |
| C. | H+从a极向b极移动 | |
| D. | 负极反应式为:SO2+2H2O-2e-=SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{83}^{209}$Bi比${\;}_{83}^{210}$Bi的质量数小1 | |
| B. | ${\;}_{83}^{209}$Bi和${\;}_{83}^{210}$Bi都含有83个中子 | |
| C. | ${\;}_{83}^{209}$Bi和${\;}_{83}^{210}$Bi的核外电子数不同 | |
| D. | ${\;}_{83}^{209}$Bi和${\;}_{83}^{210}$Bi分别含有126和127个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着核电荷数增加,碱金属单质的密度逐渐增大 | |
| B. | 随着核电荷数增加,卤素单质的熔沸点逐渐降低 | |
| C. | 随着核电荷数的增加,碱金属单质与水反应的剧烈程度增大 | |
| D. | 随着核电荷数增加,碱金属离子的氧化性逐渐增强,卤素离子的还原性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳碳双键不可旋转所以烯烃一定有顺反异构 | |
| B. | 邻二甲苯只有一种结构可以证明苯分子中无单双健的交替结构 | |
| C. | CH2Cl2无同分异构体可以证明CH4是正四面体的结构 | |
| D. | 乙烯、乙炔是平面型分子,可知CH3-CH=C(CH3)-C≡C-CH3分子中所有的碳原子共面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com