
| A. | 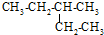 2-乙基丁烷 2-乙基丁烷 | B. | CH2=CHCH2CH3 丁烯 | ||
| C. | 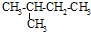 异戊烷 异戊烷 | D. | 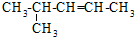 4-甲基-2-戊烯 4-甲基-2-戊烯 |
分析 A、烷烃命名选取最长碳链为主链;
B、烯烃含有官能团:碳碳双键,命名中要标明双键的位置;
C、异戊烷为其传统命名,不是系统命名;
D、烯烃命名选取含有碳碳双键的最长碳链,距离碳碳双键最近的一端为1号碳,据此解答即可.
解答 解:A、出现2乙基,说明不是选取的最长碳链,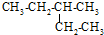 的最长碳链为5,正确命名为:3-甲基戊烷,故A错误;
的最长碳链为5,正确命名为:3-甲基戊烷,故A错误;
B、CH2=CHCH2CH3 在1、2号碳之间含有碳碳双键,正确命名为:1-丁烯,故B错误;
C、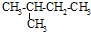 最长碳链为4,在2号碳上含有1个甲基,正确命名为:2-甲基丁烷,异戊烷不是系统命名,故C错误;
最长碳链为4,在2号碳上含有1个甲基,正确命名为:2-甲基丁烷,异戊烷不是系统命名,故C错误;
D、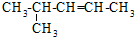 含有碳碳双键的最长碳链为5,在2、3号碳之间含有双键,正确命名为:4-甲基-2-戊烯,故D正确,故选D.
含有碳碳双键的最长碳链为5,在2、3号碳之间含有双键,正确命名为:4-甲基-2-戊烯,故D正确,故选D.
点评 本题主要考查的是烷烃的命名和烯烃的命名,在烯烃命名中应突出官能团的位置,且选取距离双键最近的一端命名为1号碳,难度不大.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:填空题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
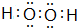 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①、④溶液中水电离的c( H+):①>④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②<③ | |
| C. | 分别向等体积的上述溶液中加入100 ml,水,溶液的pH:③>④>①>② | |
| D. | 将①、④溶液混合后pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 要提纯的物质(杂质) | CH3CH2Br (C2H5OH) | C2H5OH (H2O) | CH4 (HCHO) | C6H5Br (Br2) | C6H6 (C6H5OH) |
| 选用试剂(1) | |||||
| 分离方法(2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐和金属钠的熔化 | B. | 氯化铵和单质硫的熔化 | ||
| C. | 碘和干冰的升华 | D. | 金刚石和石灰石的熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
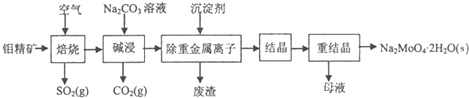
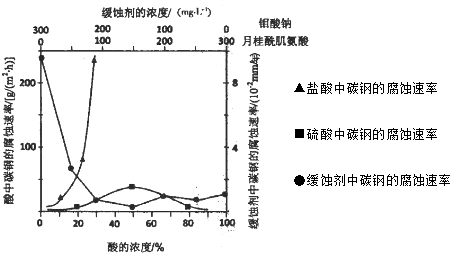
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚与浓溴水混合 | B. | 溴丙烷与NaOH溶液混合,静置 | ||
| C. | 乙醛与新制的银氨溶液水浴加热 | D. | 1-氯丁烷与乙醇、KOH共热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com