
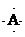 ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.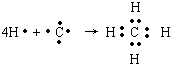 .
.分析 B原子L层的电子总数是K层的3倍,B的原子原子核外各层电子数分别为2、6,则B为O元素;A的电子式为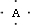 ,A和B在同一周期,则A为C元素;0.1molC单质能从酸中置换出2.24L氢气(标准状况),氢气物质的量为0.1mol,则反应中C的化合价为$\frac{0.1mol×2}{0.1mol}$=+2,故C原子最外层有2个电子,离子的与氖原子的电子层结构相同,则C为Mg元素;D离子的半径比C离子的小,D离子与B离子的电子层结构相同,D为Al元素,据此解答.
,A和B在同一周期,则A为C元素;0.1molC单质能从酸中置换出2.24L氢气(标准状况),氢气物质的量为0.1mol,则反应中C的化合价为$\frac{0.1mol×2}{0.1mol}$=+2,故C原子最外层有2个电子,离子的与氖原子的电子层结构相同,则C为Mg元素;D离子的半径比C离子的小,D离子与B离子的电子层结构相同,D为Al元素,据此解答.
解答 解:B原子L层的电子总数是K层的3倍,B的原子原子核外各层电子数分别为2、6,则B为O元素;A的电子式为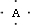 ,A和B在同一周期,则A为C元素;0.1molC单质能从酸中置换出2.24L氢气(标准状况),氢气物质的量为0.1mol,则反应中C的化合价为$\frac{0.1mol×2}{0.1mol}$=+2,故C原子最外层有2个电子,离子的与氖原子的电子层结构相同,则C为Mg元素;D离子的半径比C离子的小,D离子与B离子的电子层结构相同,D为Al元素.
,A和B在同一周期,则A为C元素;0.1molC单质能从酸中置换出2.24L氢气(标准状况),氢气物质的量为0.1mol,则反应中C的化合价为$\frac{0.1mol×2}{0.1mol}$=+2,故C原子最外层有2个电子,离子的与氖原子的电子层结构相同,则C为Mg元素;D离子的半径比C离子的小,D离子与B离子的电子层结构相同,D为Al元素.
(1)C为Mg元素,在周期表中的位置:第三周期第ⅡA族,
故答案为:第三周期、第ⅡA族;
(2)A的气态氢化物为CH4,用电子式表示形成过程: ,
,
故答案为: ;
;
(3)A的单质和B的单质充分反应生成化合物为CO2,结构式是O=C=O,
故答案为:O=C=O;
(4)四种元素中,最高价氧化物的水化物既能溶于酸,又能溶于碱,该物质为Al(OH)3,其溶于NaOH溶液的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O.
点评 本题考查元素位置结构性质关系及应用,题目难度中等,根据题干中信息推断出具体的元素是解题的关键,注意掌握用电子式表示化学键或物质的形成过程,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:多选题
| A. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4 NH3•H2O═[Al(OH)4]-+4NH4+ | |
| B. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O | |
| C. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 物质 | 杂质 | 除杂试剂 | 除去杂质的方法 |
| A | NaCl溶液 | BaCl2 | Na2CO3溶液 | 过滤 |
| B | NaCl溶液 | I2 | CCl4 | 多次萃取、分液 |
| C | CCl4 | 汽油 | H2O | 分液 |
| D | CO2 | HCl | NaOH溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
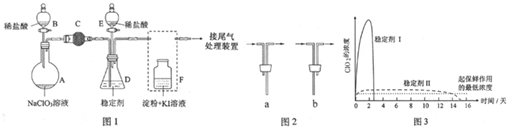
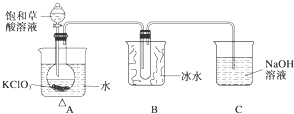 某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率).
某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率).| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入足量0.1 mol•L-1 HCl. | |
| 步骤2:往步骤1的剩余物中,再滴加几滴0.01 mol•L-1 KMnO4. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
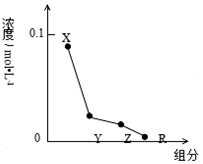
| A. | MOH的电离方程式:MOH═M++OH- | |
| B. | 该混合液中水电离出的c(H+)<l0-7mol/L | |
| C. | 该混合溶液中:c(Y)+c(X)═c(R)+c(Z) | |
| D. | 图中c(X)+c(Z)═0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
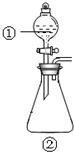 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 立即产生大量白色沉淀 |
| D | 氨水 | 硝酸银溶液 | 先产生白色沉淀后沉淀逐渐溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
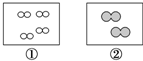 如图所示,①和②为两个体积相同的固定容器,图中“○”和“●”分别表示氢原子和氧原子,则下列说法正确的是( )
如图所示,①和②为两个体积相同的固定容器,图中“○”和“●”分别表示氢原子和氧原子,则下列说法正确的是( )| A. | 若①中的H2为1 mol,则②中所含原子总数为3.01×1023个 | |
| B. | ①和②中气体的质量之比为1:8 | |
| C. | H2、O2均能发生化合反应,但不能发生置换反应 | |
| D. | 两容器的温度和压强均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com