
| A.用醋酸钠晶体和碱石灰共热制甲烷 |
| B.将铁屑、溴水、苯混合制溴苯 |
| C.在苯酚溶液中滴人少量稀溴水出现白色沉淀 |
| D.将铜丝在酒精灯上加热后,立即伸人无水乙醇中,铜丝恢复成原来的红色 |
科目:高中化学 来源:不详 题型:单选题
| A.SO2使品红褪色的机理和使酸性KMnO4褪色的机理一样 |
| B.蛋白质溶液和蔗糖溶液可以用丁达尔现象来区别,因为分散质颗粒大小不同 |
| C.将BaSO4投入饱和Na2CO3溶液,能生成BaCO3,据此可确定Ksp(BaCO3)< Ksp(BaSO4 |
| D.(NH4)2CO3(s)=NH4HCO3(s) +NH3(g)△H>0在室温下能自发,因为体系熵值增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
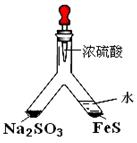
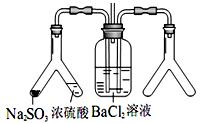
 验目的:探究 SO2与BaCl2反应产生沉淀的条件。二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧 Y型管中应放置的药品是____________和___________(必要时可以加热),该沉淀的化学式为________________。
验目的:探究 SO2与BaCl2反应产生沉淀的条件。二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧 Y型管中应放置的药品是____________和___________(必要时可以加热),该沉淀的化学式为________________。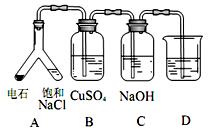
 证电石气的主要成分,D中盛放______________。
证电石气的主要成分,D中盛放______________。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2气体能使品红和酸性高锰酸钾溶液褪色,且原理相同 |
| B.氨气可将NO2 转化成无毒的物质,是因为氨气具有还原性 |
| C.NH4NO3溶液和HNO3溶液中滴加石蕊都变红色,是因为它们均能电离出H+ |
| D.pH=3的盐酸与pH=11的MOH溶液等体积混合后溶液呈碱性,说明MOH为弱碱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
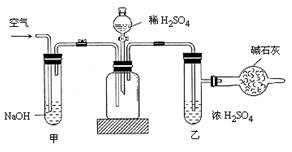
| A.在干燥管内填满碱石灰,质量为mg |
| B.取ng样品装入广口瓶中 |
| C.检查装置气密性 |
| D.关闭止水夹 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
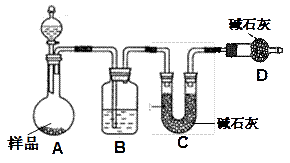
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
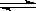 H++ClO-,为了探究HClO的漂白性,甲同学设计了如下的实验。
H++ClO-,为了探究HClO的漂白性,甲同学设计了如下的实验。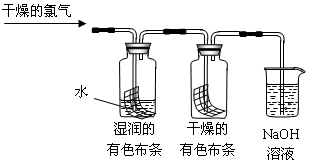
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
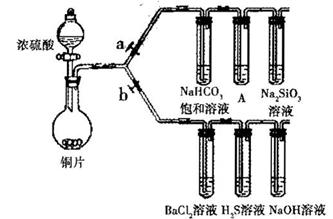
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | | |
 还原性并生成沉淀的离子方程式_________
还原性并生成沉淀的离子方程式_________查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
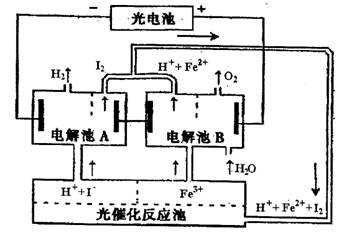
|
| A.设计该循环系统的目的是制取I2 | B.电解池A中离子反应方程式: |
C.光催化反应池中离子反应方程式为: | |
| D.该系统中的Fe3+、H2O、I-都是循环使用的物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com