
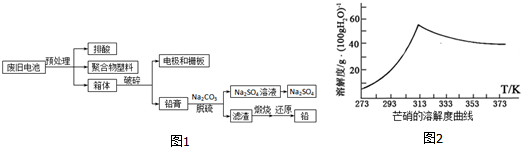
分析 处理铅酸蓄电池过程中,为了达到节能减排、防治污染和资源循环利用的目的,废旧电池的预处理时需要将电池放电完全,将电极材料全部转换为PbSO4,再加入碳酸钠通过沉淀转化为碳酸铅,同时得到产品硫酸钠,
(1)在原电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应,将正负极电极反应式相加即可得电池反应式;
(2)废旧电池的预处理时需要将电池放电完全,目的是将电极材料全部转换为PbSO4;
(3)Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,碳酸铅更难溶,实现了沉淀的转化;
(4)使用纯碱脱硫的显著优点是可以减小污染,对环境友好;
(5)依据图象的溶解度随温度变化分析判断,得到硫酸钠的适宜条件,注意溶解度的影响;
(6)根据PbS+2Fe[BF4]3=Pb[BF4]2+2Fe[BF4]2+S,可知氟硼酸铁浸出PbS后得到浸出液,浸出液含Pb[BF4]2、Fe[BF4]2,电解过程中Pb[BF4]2得电子发生还原反应生成铅,Fe[BF4]2失电子发生氧化反应生成Fe[BF4]3.
解答 解:(1)铅蓄电池的负极反应为:Pb+SO4 2--2e-=PbSO4,正极反应为:PbO2+4H++SO4 2-+2e-=PbSO4+2H2O,将正负极电极反应式相加即可得电池反应式,所以电池反应式为Pb+PbO2+2H2SO4 ═2PbSO4+2H2O,
故答案为:Pb+PbO2+2H2SO4 ═2PbSO4+2H2O;
(2)废旧电池的预处理时需要将电池放电完全,目的是将电极材料全部转换为PbSO4,
故答案为:将电极材料全部转换为PbSO4;
(3)Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,碳酸铅更难溶,实现了沉淀的转化,铅膏脱硫时的离子方程式:PbSO4+CO32-=SO42-+PbCO3,
故答案为:PbSO4+CO32-=SO42-+PbCO3;
(4)使用纯碱脱硫的显著优点是可以减小污染,对环境友好,
故答案为:可以减小污染,对环境友好;
(5)图象分析可知温度高时析出硫酸钠,温度低时析出硫酸钠结晶水合物晶体,所以需要趁热过滤;洗涤晶体时用乙醇洗涤避免形成结晶水合物,
故答案为:趁热过滤;防止形成Na2SO4•10H2O;
(6)根据PbS+2Fe[BF4]3=Pb[BF4]2+2Fe[BF4]2+S,可知氟硼酸铁浸出PbS后得到浸出液,浸出液含Pb[BF4]2、Fe[BF4]2,电解过程中Pb[BF4]2得电子发生还原反应生成铅,Fe[BF4]2失电子发生氧化反应生成Fe[BF4]3,电解总反应为:Pb[BF4]2+2Fe[BF4]2$\frac{\underline{\;电解\;}}{\;}$Pb+2Fe[BF4]3,
故答案为:Pb[BF4]2+2Fe[BF4]2$\frac{\underline{\;电解\;}}{\;}$Pb+2Fe[BF4]3.
点评 本题以电化学为载体考查物质的分离和提纯的方法和基本操作,是对学生综合能力的考查,需要学生基本扎实的基础与运用知识分析解决问题的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+数为2NA | |
| C. | 标准状况下,22.4L水中含有共价键数为2NA | |
| D. | 50mL 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛和甲苯都能与溴水反应 | |
| B. | 蛋白质和油脂都属于天然高分子化合物 | |
| C. | 甲烷中混有的乙烯可通过溴的四氯化碳除去 | |
| D. | 苯酚能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (A-N+3)mol | B. | $\frac{n}{A+3}$(A-N+3)mol | C. | $\frac{n}{A}$(A-N+3)mol | D. | $\frac{n}{A+3}$(A-N-3)mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com