
【题目】某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。回答下列问题
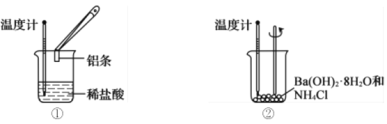
(1)装置①中反应物的总能量比生成物的总能量________(填标号)。
a.高 b.低 c.相等
(2)装置②中反应后溶液的温度__________(填标号)。
a.升高 b.降低 c.不变
(3)已知断裂1mo1共价键需要吸收的能量分别为 H —H :436kJ,I —I :151kJ,H— I :299kJ。则反应 H2+I2 = 2HI的能量变化为______(填标号)。
a.无能量变化 b.吸热 c.放热
(4)碱金属单质在空气中燃烧的产物与碱金属的活动性有关。锂单质在空气中燃烧得到的产物的化学式为__________。
【答案】a b c Li2O
【解析】
(1)活泼金属与酸的反应为放热反应;
(2)氢氧化钡晶体与氯化铵的反应为吸热反应;
(3) 根据△H=反应物的键能和-生成物的键能和分析;
(4) 锂的活泼性小于钠,则锂与氧气反应生成氧化锂。
(1)装置①中Al与稀盐酸的反应为放热反应,则反应物的总能量比生成物的总能量高,答案选a;
(2)装置②中氯化铵与氢氧化钡晶体的反应为吸热反应,反应后溶液的温度会降低,答案选b;
(3)反应H2(g)+I2(g)=HI(g)的△H=反应物的键能和生成物的键能和=436kJ/mol+151kJ/mol2×299kJ/mol=11kJ/mol,焓变小于0,所以该反应为放热反应,答案选c;
(4)碱金属单质在空气中燃烧的产物与碱金属的活泼性有关,Li的活泼性小于Na,则Li在空气中燃烧生成的产物为Li2O。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列各组粒子在溶液中可以大量共存,且加入或通入试剂M后,发生反应的离子方程式也正确的是
选项 | 微粒组 | 试剂M | 发生反应的离子方程式 |
A | K+、Na+、 | 少量HCl | 2H++ |
B |
| 过量H2S | Fe2++H2S |
C | HClO、Na+、Fe3+、 | 过量CaCl2 | Ca2++ |
D |
| 少量CO2 | CO2+2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)家用液化气的主要成分之一是丁烷(C4H10),当1 kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式:________
(2)已知:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
现有0.2 mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为_______________。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) △H=—24.8 kJ·mol-1
3Fe2O3 (s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=—47.4 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5 kJ·mol-1
写出CO(g)还原FeO(s)得到Fe (s)体和CO2(g)的热化学反应方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,将浓度均为0.1mol/L的HA溶液Va mL和BOH溶液Vb mL混合,保持Va+Vb=100mL,生成物BA易溶于水。Va、Vb与混合液pH的关系如下图。下列叙述错误的是

A.HA一定是弱酸
B.BOH可能是强碱
C.z点时,水的电离被促进
D.x、y、z点时,溶液中都存在c(A-)+c(OH-)=c(B+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置探究NH3和CuSO4溶液的反应。
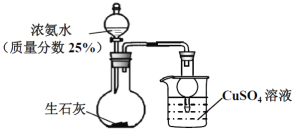
(1)上述制备NH3的实验中,烧瓶中反应涉及到多个平衡的移动:NH3+H2O![]() NH3H2O、____________、_________________(在列举其中的两个平衡,可写化学用语也可文字表述)。
NH3H2O、____________、_________________(在列举其中的两个平衡,可写化学用语也可文字表述)。
(2) 制备100mL25%氨水(ρ=0.905gcm-3),理论上需要标准状况下氨气______L(小数点后保留一位)。
(3) 上述实验开始后,烧杯内的溶液__________________________,而达到防止倒吸的目的。
(4)NH3通入CuSO4溶液中,产生蓝色沉淀,写出该反应的离子方程式。_______________________。继续通氨气至过量,沉淀消失得到深蓝色[Cu(NH3)4]2+溶液。发生如下反应:2NH4+(aq)+Cu(OH)2(s)+2NH3(aq)![]() [Cu(NH3)4]2+(aq)(铜氨溶液)+2H2O+Q(Q>0)。
[Cu(NH3)4]2+(aq)(铜氨溶液)+2H2O+Q(Q>0)。
①该反应平衡常数的表达式K=___________________________。
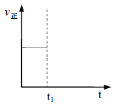
②t1时改变条件,一段时间后达到新平衡,此时反应K增大。在下图中画出该过程中v正的变化___________________。
③向上述铜氨溶液中加水稀释,出现蓝色沉淀。原因是:________________________________。
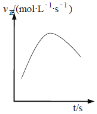
④在绝热密闭容器中,加入NH4+(aq)、Cu(OH)2和NH3(aq)进行上述反应,v正随时间的变化如下图所示,v正先增大后减小的原因__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了确认乙酸、碳酸和硅酸的酸性强弱,有人设计用如图所示装置,一次实验达到目的(不能再选用其他酸性溶液)。

(1)锥形瓶内装有某种可溶性正盐固体(含有3种酸的酸根的其中一种),此固体为________,分液漏斗中所盛试剂是___。
(2)装置B中所盛试剂的名称是________,试剂的作用是__________。
(3)装置C中出现的现象是__________________。
(4)由实验可知三种酸的酸性大小顺序为________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(含2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如下:
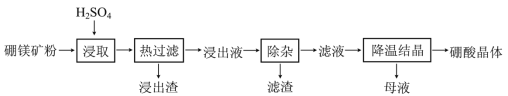
已知:H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0 g、8.7 g、14.8 g、40.2g。Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4。
(1)“浸取”时主要反应的化学方程式为_____________________。
(2)“浸取”后,采用“热过滤”的目的是___________________________。
(3)“浸出液”显酸性,含H3BO3和Mg2+、SO42-,还含有其他杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO,除去的杂质离子是__________。H2O2的作用是______(用离子方程式表示)。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4H2O,应采取的措施是将“母液”蒸发浓缩后,最佳结晶条件是_____________。
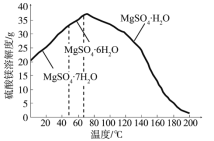
A. 升温结晶 B. 降温结晶 C. 加压升温结晶 D. 降压降温结晶
(5)在实际生产中为了提高原料的综合利用率,可以利用除杂后滤渣作为提炼铝的原料,工艺流程为:
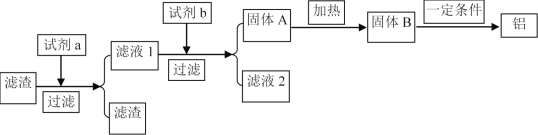
试剂a可选用________(化学式)溶液,若试剂b为AlCl3则由滤液得固体A的离子反应方程式为___________,在实际工业生产中,流程中的一定条件指的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧硫化碳(COS,结构类似于CO2)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。有多种方法可以脱氧硫化碳中的硫,其中氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g) + H2(g)H2S(g) + CO(g) ΔH1= + 7kJ/mol
②水解反应:COS(g) + H2O(g)H2S(g) + CO2(g) ΔH2= -35 kJ/mol
请回答下列问题:
(1)氧硫化碳的电子式为____________。
(2)CO2和H2能反应生成CO和H2O(g),写出该反应的热化学方程式______________。
(3)在密闭恒温(高于100℃)恒容装置中进行水解反应,下列能说明达到平衡状态的是___________________。
A.混合气体密度不再改变 B.混合气体压强不再改变
C.混合气体平均摩尔质量不再改变 D. COS(g) 的浓度不变
(4)①上述氢解反应的平衡常数K随温度降低而________(填“增大”或“减小”)。
②某温度下,体积为2L的恒容体系中,物质的量分别为m mol、n mol的COS蒸气和H2气发生氢解,已知COS的转化率为α,则该温度下的平衡常数K=___________(用m、n、α等符号表示)。
(5)某科研小组研究改进催化剂TiO2/Al2O3和温度对COS水解的影响,得到如图图像:
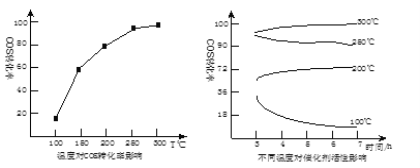
COS水解的最佳温度是 __________ ;理由是 ________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示表示页岩气中某些烃类的结构模型:

(1)有机物甲的名称为____________,有机物甲与有机物乙互为____________。
(2)有机物乙的一氯取代物有________种,请你根据甲烷分子结构示意图推测,有机物乙中最多有________个C原子在同一平面内。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com