
| A. | CH3COONa固体 | B. | Na2SO4固体 | C. | 少量NH4HSO4固体 | D. | NaOH固体 |
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 用排水法收集铜粉与浓硝酸反应产生的NO2 | |
| B. | 用氨水鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液 | |
| C. | 用酸性KMnO4溶液验证草酸的还原性 | |
| D. | 用饱和NaHCO3溶液除去Cl2中混有的HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
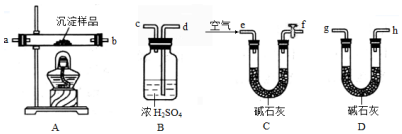
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与浓硫酸共热有气体放出 | |
| B. | 用玻璃棒蘸浓硫酸滴在白纸上,白纸变黑 | |
| C. | 把木炭放入热的浓硫酸中,有气体放出 | |
| D. | 常温下可用铁、铝制容器盛装冷的浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多空的海绵状碳 | 浓硫酸具有脱水性和强氧化性 |
| B | 盛有H2O2溶液的试管中加入几滴酸化的硫酸亚铁溶液. | 溶液变成棕黄色,一段时间后,溶液中有气泡出现,随后有红褐色沉淀生成. | Fe2+催化H2O2分解产生O2; H2O2分解反应放热,促进Fe3+的水解平衡正向移动. |
| C | 将盛有铜片的容器中加入浓硝酸 | 产生大量红棕色气体,溶液变为蓝绿色 | 浓硝酸具有强氧化性 |
| D | 向等浓度的KCl、KI混合液中逐滴滴加AgNO3 溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp (AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的导电性 | B. | 醋酸的电离常数 | ||
| C. | 完全中和时所需NaOH的量 | D. | H+的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
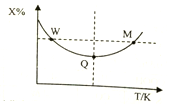 在2L恒容密闭容器中充入2molX和1molY发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )
在2L恒容密闭容器中充入2molX和1molY发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )| A. | Q点时,Y的转化率最大 | |
| B. | 升高温度,平衡常数增大 | |
| C. | W点X的正反应速率等于M点X的正反应速率 | |
| D. | 平衡时,X的转化率大于Y的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向容量瓶转移液体时,玻璃棒下端伸入到容量瓶刻度线以下 | |
| B. | 用玻璃棒蘸取CH3COOH溶液点在已湿润的pH试纸上,测定该溶液的pH | |
| C. | 用长颈漏斗分离乙酸乙酯和水 | |
| D. | 淀粉溶液与硫酸共热后,加入新制氢氧化铜加热,无砖红色沉淀生成,说明淀粉没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
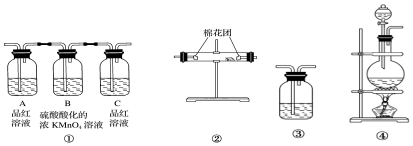
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com