
【题目】下列反应的离子方程式正确的是( )
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.氯气与水反应: Cl2+H2O=2H++Cl-+ClO-
C.氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O
D.将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
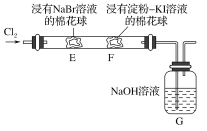
A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为:Cl2+2Br-===2Cl-+Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为:2OH-+Cl2===ClO-+Cl-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习小组进行CH4的制备及性质探究实验。根据反应:CH3COONa(固体)+NaOH(固体)→ Na2CO3+CH4↑制备气体。
(1)用CH4气体分别进行下列实验:
①通入酸性KMnO4溶液,现象是______________________________。
②在无色玻璃集气瓶中与C12混合后光照,现象是___________________________。
(2)为了验证CH4是否具有还原性,某小组设计了如下实验:

①当玻璃管中的氧化铜由黑色变为红色时,说明CH4具有还原性。你认为这一结论是否正确?__________(填“正确”或“不正确”),理由是______________________________。
②实验过程中还观察到无水CuSO4逐渐变蓝,澄清石灰水出现浑浊现象,则CH4与CuO反应的化学方程式为______________________________。
(3)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是______________。请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】150℃时,11.6g CO2和H2O的混合气体与足量的Na2O2充分反应后,固体物质的质量增加了3.6g,则原混合气体中CO2与H2O的物质的量之比是( )
A.1:4B.3:11C.1:11D.21:22
查看答案和解析>>
科目:高中化学 来源: 题型:
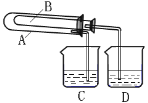
【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品、用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。

(1)A是制取CO2的装置。写出A中发生反应的方程式______________。
(2)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | _________ |
C | _________ | _________ |
D | _________ | _________ |
(3)写出过氧化钠与二氧化碳反应的化学方程式:__________。
(4)某课外小组为了验证Na2CO3和NaHCO3的稳定性,设计了如图所示的实验装置,你认为在试管B中应放的物质是_______,C、D两个烧杯中的溶液分别是______、_______,Na2CO3粉末中混有少量NaHCO3,除去杂质的方法(写方程式)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )

A. X+3Y![]() 2Z 0.1 mol/(L·min) B. 2X+Y
2Z 0.1 mol/(L·min) B. 2X+Y![]() 2Z 0.1 mol/(L·min)
2Z 0.1 mol/(L·min)
C. X+2Y![]() Z 0.05 mol/(L·min) D. 3X+Y
Z 0.05 mol/(L·min) D. 3X+Y![]() 2Z 0.05 mol/(L·min)
2Z 0.05 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
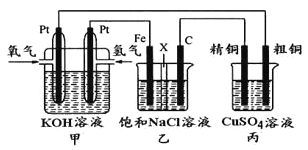
根据要求回答相关问题:
(1)甲装置中通入氧气的电极为______________(填“正极”或“负极”),负极的电极反应式为_________________。
(2)乙装置中铁电极为_______(填“阳极”或“阴极”),石墨电极(C)上发生_____反应(填“氧化”或“还原”),其电极反应式为___________________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在_____________区。(填“铁极”或“石墨极”)
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将_______(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为_____;丙装置中阴极析出铜的质量为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com