
分析 (1)在NaHCO3溶液中存在碳酸氢根离子的水解平衡和电离平衡;水的电离平衡;溶液显碱性是因为溶液中碳酸氢根离子的水解程度大于电离程度;
(2)配制氯化铁溶液需要防止水解而变浑浊;NaHCO3溶液和FeCl3溶液混合发生双水解生成氢氧化铁沉淀和二氧化碳气体;
(3)依据溶液中铵根离子水解,溶液呈酸性,水解程度微弱,分析比较;
(4)①氯化银饱和溶液中存在沉淀溶解平衡,饱和溶液中的溶度积是常数,只随温度变化,依据溶度积分别计算;
②100mL 0.2mol/L AgNO3溶液中,银离子的浓度为0.2mol/L,根据氯化银的Ksp=1.8×10-10计算.
解答 解:(1)在NaHCO3溶液中存在碳酸氢根离子的水解平衡为:HCO3+H2O?H2CO3+OH-,电离平衡为:HCO3-?H++CO32-;而以水解为主,即碳酸氢根离子的水解程度大于电离程度溶液,故显碱性;
故答案为:HCO3-的水解程度大于其电离程度,溶液中c(OH-)>c(H+),故溶液显碱性;
(2)实验室中配制FeCl3溶液时通常需要向其中加盐酸抑制Fe3+水解,NaHCO3溶液和FeCl3溶液混合发生双水解生成氢氧化铁沉淀和二氧化碳气体;反应的离子方程式为Fe3++3HCO3-=Fe(OH)3↓+3CO2↑,
故答案为:盐酸;Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;
(3)铵根离子水解,溶液呈酸性,c(H+)>c(OH-),.1mol•L-1的(NH4)2SO4溶液中,铵根离子水解微弱,所以得到溶液中的离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(4)①①100mL 0.2mol•L-1AgNO3溶液中Ag+浓度为0.2mol/l抑制沉淀溶解平衡,③100mL 0.1mol•L-1氯化铝溶液中氯离子浓度为0.3mol/L,银离子浓度=6×10-10mol/L;④100mL 0.1mol•L-1盐酸溶液中氯离子浓度为0.1mol/L,银离子为1.8×10-9mol/L;综上所述大小顺序为:②>①>④>③,
故答案为:②>①>④>③;
②100mL 0.2mol/L AgNO3溶液中,银离子的浓度为0.2mol/L,加如氯化银后,氯离子浓度为$\frac{1.8×1{0}^{-10}}{0.2}$=9×10-10mol/L,故答案为:9×10-10.
点评 本题考查了盐类水解的应用、溶液中离子浓度大小的比较、溶液中平衡的分析、溶解度常数的有关计算等知识,注意知识的归纳和整理是关键,难度不大,注意把握溶度积在计算中应用.


科目:高中化学 来源: 题型:选择题
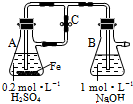
| A. | 用图装置可以制备沉淀Fe(OH)2 | |
| B. | 配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 | |
| C. | FeCl3溶液中滴加KSCN溶液会生成红色沉淀 | |
| D. | 向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 只有③ | B. | ②③ | C. | ①③⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
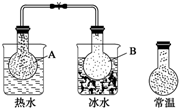 已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )| A. | 反应2NO2(g)?N2O4(g)的正反应为吸热反应 | |
| B. | 上述过程中,A烧瓶内正、逆反应速率均加快 | |
| C. | 上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大 | |
| D. | 上述过程中,A、B烧瓶内气体密度均保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有②③⑤ | C. | ②③④⑤ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.08mol | B. | 小于0.54mol | ||
| C. | 在0.54~1.08mol之间 | D. | 大于0.54mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com