B
分析:铜和镁失去的电子的物质的量,等于硝酸被还原为二氧化氮、四氧化二氮获得的电子的物质的量,等于他们结合的氢氧根的物质的量,根据氮的氧化物计算氢氧根的物质的量,沉淀为氢氧化镁、氢氧化铜,沉淀的总质量等于金属质量与氢氧根的质量之和.
解答:2.24L的NO
2气体的物质的量为
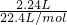
=0.1mol,168mL的N
2O
4气体的物质的量为
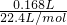
=0.0075mol,
所以金属提供的电子的物质的量为0.1mol×(5-4)+0.0075mol×2×(5-4)=0.115mol,
所以沉淀中含有氢氧根的物质的量为0.115mol,氢氧根的质量为0.115mol×17g/mol=1.955g,
所以沉淀的金属的质量为2.3g+1.955gg=4.255g,
故选B.
点评:本题考查混合物的计算,题目难度中等,本题解答的关键是铜和镁失去的电子的物质的量,等于他们结合的氢氧根的物质的量,而结合氢氧根的质量就正好是质量增加的量.

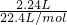 =0.1mol,168mL的N2O4气体的物质的量为
=0.1mol,168mL的N2O4气体的物质的量为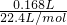 =0.0075mol,
=0.0075mol,
