
| A、CF2Cl2 |
| B、CH3CH2OH |
C、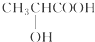 |
| D、CH2═CH-COOH |
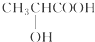 中间的碳原子连有的四个不同取代基,该碳原子具有手性,故C正确;
中间的碳原子连有的四个不同取代基,该碳原子具有手性,故C正确;

科目:高中化学 来源: 题型:
| 弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
| 电离平衡常数 | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 | 1.8×l0-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S2Cl2分子中各原子均达到8电子稳定结构 |
| B、制备S2Cl2的反应是化合反应,不是氧化还原反应 |
| C、S2Cl2遇水反应的化学方程式为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl |
| D、S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| B、c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C、c(NO3-)>c(K+)>c(Ag+)>c (Cl-)>c(I-) |
| D、c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B、含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C、CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) |
| D、NaHCO3溶液:c(H+)+c(HCO3-)+c(CO32-)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
| A、实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol?L-1?min-1 |
| B、实验②中,该反应的平衡常数K=2.0 |
| C、实验③中,达到平衡时,X的转化率为40% |
| D、实验④中,达到平衡时,b<0.060 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、0.3mol |
| B、0.15mol |
| C、小于0.15mol |
| D、大于0.15mol,小于0.3mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com