
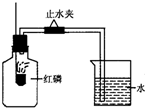
 已知空气的主要成分是氮气和氧气,某课外活动小组设计测定空气中氧气含量的实验,实验装置如图所示:
已知空气的主要成分是氮气和氧气,某课外活动小组设计测定空气中氧气含量的实验,实验装置如图所示:
| ||
| ||
| 1 |
| 5 |
| 1 |
| 5 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.
某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
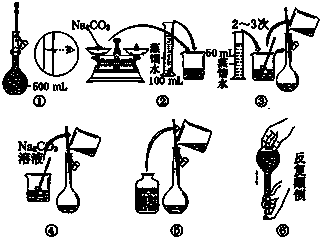 (1)若某药品质量约为32g
(1)若某药品质量约为32g| 50g | 20g | 20g | 10g | 5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+ Na+ SO42- Cl- |
| B、K+ Na+ S2- NO3- |
| C、Mg2+ NH4+ SO42- Cl- |
| D、K+ Na+ AlO2- ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com