
在0.25mol Na2O中,含有的氧离子数约为( )。
A. 1个 B. 0.25个 C. 1.5×1023个 D. 6.02×1023个
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
下列说法,你认为不正确的是( )。
A.平衡常数随温度的改变而改变
B.对于密闭容器中反应2SO2+O2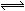 2SO3,2体积SO2与足量O2反应,能生成2体积SO
2SO3,2体积SO2与足量O2反应,能生成2体积SO 3
3
C.合成氨反应中使用催化剂,降低了反应所需要的活化能。
D.反应H2(g)+I2 (g)
(g)  2HI(g) 在450℃时,其平衡常数为49;则反应
2HI(g) 在450℃时,其平衡常数为49;则反应
HI(g)  1 ∕ 2 H2(g) +1 ∕ 2 I2(g) 在450℃时的平衡常数为1 ∕ 7
1 ∕ 2 H2(g) +1 ∕ 2 I2(g) 在450℃时的平衡常数为1 ∕ 7
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氯气的叙述正确的是
A.氢气在氯气中燃烧产生苍白色火焰
B.氯气的水溶液用于漂白,是利用氯气的强氧化性
C.铁丝在氯气中燃烧生成FeCl2
D.当有大量氯气逸到空气中时,可用浸有NaOH溶液的毛巾捂住鼻子
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,关于PH=1的醋酸溶液的下列说法中正确的是
A.加入等体积的水,c(H+)、c(OH-)都减小
B.加水稀释时醋酸和水的电离度都增大
C.加入少量醋酸钠固体pH 一定降低
D.稀释100倍pH变为3
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g) + O2(g) 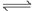 2NO(g) △H > 0
2NO(g) △H > 0
已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该反应的平衡常数表达式为 。
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是 %(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是
。
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是
(填字母序号)。
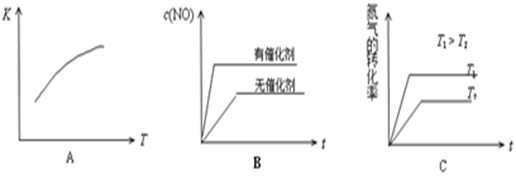
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数 (填“变大、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
铜的摩尔质量为M g/mol,密度为d g/cm3,阿伏加德罗常数为NA,下列说法正确的是( )。
A.1kg铜所含原子的数目为dNA
B.一个铜原子所占有的体积为(M/d)NA cm3
C.一个铜原子的质量为M/NA g
D.1dm3铜所含有的原子数为dNA/M
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中均需要的仪器是( )
①配制一定物质的量浓度的溶液 ②PH试纸的使用 ③过滤 ④蒸发.
|
| A. | 试管 | B. | 胶头滴管 | C. | 玻璃棒 | D. | 漏斗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )。
A.因为SiO2是H2SiO3的酸酐,故SiO2溶于水得H2SiO3
B.CO2通入水玻璃(Na2SiO3的水溶液)中可以得到硅酸沉淀
C.因为高温时发生反应:Na2CO3+SiO2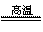 Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
D.SiO2是酸性氧化物,它不溶于任何酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com