
 (1)明矾可用于净水,用离子方程式解释其原因Al3++3H2O?Al(OH)3(胶体)+3H+.把FeCl3溶液蒸干、灼烧、最后得到的主要固体产物是Fe2O3.
(1)明矾可用于净水,用离子方程式解释其原因Al3++3H2O?Al(OH)3(胶体)+3H+.把FeCl3溶液蒸干、灼烧、最后得到的主要固体产物是Fe2O3.分析 (1)明矾水解生成具有吸附性的氢氧化铝胶体;将FeCl3溶液蒸干时,铁离子水解生成Fe(OH)3和HCl,升高温度促进HCl挥发,所以蒸干溶液时得到碱,灼烧Fe(OH)3时,Fe(OH)3会分解;
(2)醋酸钠溶液中,醋酸根离子结合水电离的氢离子,溶液显示碱性;
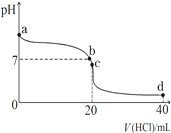
(3)①根据电荷守恒,和溶液呈中性;
②恰好完全反应时,生成氯化铵,强酸弱碱盐,水解呈酸性;
③c点时氨水与盐酸恰好反应生成氯化铵溶液,根据盐的水解原理、电荷守恒判断溶液中各离子浓度大小.
解答 解:(1)明矾水解生成氢氧化铝胶体,具有吸附性,反应的离子方程式为Al3++3H2O?Al(OH)3(胶体)+3H+,将FeCl3溶液蒸干时,铁离子水解生成Fe(OH)3和HCl,升高温度促进HCl挥发,所以蒸干溶液时得到碱,灼烧氢氧化铁时,氢氧化铁会分解,反应方程式为2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,所以最终得到的是红棕色固体Fe2O3,
故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;Fe2O3;
(2)CH3COONa溶液中,醋酸根离子发生水解生成醋酸和氢氧根离子,溶液显示碱性,离子方程式为:CH3COO-+H2O?CH3COOH+OH-,
故答案为:碱; CH3COO-+H2O?CH3COOH+OH-;
(3)①根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-),和溶液呈中性c(H+)=c(Cl-),所以c(NH4+)=c(Cl-),故答案为:等于;
②恰好完全反应时,生成氯化铵,强酸弱碱盐,水解呈酸性,水解方程式为:NH4++H2O?NH3?H2O+H+,故答案为:酸;NH4++H2O?NH3?H2O+H+;
③c点时,加入20mL盐酸,氨水与盐酸恰好完全反应生成氯化铵溶液,由于铵根离子部分水解,溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-)可得:(Cl-)>c(NH4+),溶液中各离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);c(Cl-)+c(OH-).
点评 本题考查了盐的水解原理、酸碱混合的定性判断、离子浓度大小比较,题目难度中等,注意掌握溶液酸碱性的定性判断方法,能够根据电荷守恒、盐的水解原理判断溶液中各离子浓度大小.


科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 使石蕊呈红色的溶液:NH4+、Ba2+、ClO-、Cl- | |
| C. | 使酚酞呈红色的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯(液溴),加四氯化碳、萃取 | |
| B. | 乙烷(乙烯),通入高锰酸钾溶液、洗气 | |
| C. | 溴乙烷(乙醇),加水振荡、分液 | |
| D. | 乙酸乙酯(乙酸),加氢氧化钠溶液振荡、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①AgNO3;②NaBr;③AgBr | B. | ①AgNO3;②NaCl;③AgCl | ||
| C. | ①AgCl; ②AgNO3;③NaCl | D. | ①AgNO3;②NaCl;③Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
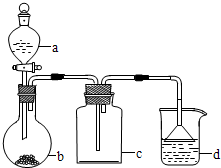
| 选项 | a种物质 | b种物质 | c种物质 | d中收集的气体 |
| A | 浓氨水 | NaOH | 浓硫酸 | NH3 |
| B | 稀盐酸 | CaCO3 | 浓硫酸 | CO2 |
| C | 稀硝酸 | Cu | 碱石灰 | NO |
| D | 浓盐酸 | KMnO4 | 水 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

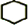 ,B名称是1,2-二溴环己烷
,B名称是1,2-二溴环己烷 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$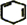 +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、NO3-、SO32- | B. | K+、Cl-、NO3-、Fe2+ | ||
| C. | NH4+、Al3+、NO3-、SO42- | D. | K+、Na+、HCO3-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com