
| A. | 化学反应速率 | B. | 化学平衡常数 | ||
| C. | 弱电解质的电离常数 | D. | 反应的活化分子百分数 |
分析 A、升高温度,化学反应速率加快;
B、化学反应的平衡常数与温度的关系和反应的吸放热之间有关系;
C、电离过程是吸热的,升温可以使电离平衡常数增加;
D、升高温度,反应的活化分子百分数增加.
解答 解:A、升高温度,化学反应速率一定加快,故A不选;
B、化学反应的平衡常数与温度的关系和反应的吸放热之间有关系,只有吸热反应,升温,平衡常数增加,但是放热反应,升温,平衡常数减小,故B选;
C、电离过程是吸热的,升温可以使电离平衡常数增加,故C不选;
D、升高温度,反应的活化分子百分数增加,故D不选.
故选B.
点评 本题考查学生温度对化学反应速率、平衡常数、活化分子百分数的影响知识,注意化学反应的平衡常数与温度的关系和反应的吸放热之间有关系是易错点.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
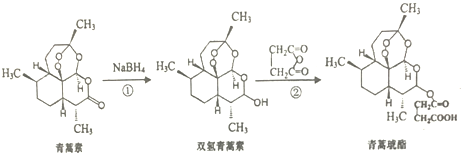
| A. | 青嵩素分子式为C15H23O5 | B. | 青嵩素不能与NaOH溶液反应 | ||
| C. | 反应②原子利用率为100% | D. | 青嵩琥不能与碳酸氢钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
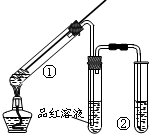
| A. | 品红溶液的作用是吸收SO2,防止污染空气 | |
| B. | 试管②中盛放的试剂通常是NaOH溶液 | |
| C. | 试管①中有白色固体生成,向①中加水后溶液呈蓝色 | |
| D. | 该反应中浓硫酸既表现了强氧化性,又表现了酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中,非金属单质一定被还原 | |
| B. | 由H2O2→O2的过程一定需加入氧化剂才能实现 | |
| C. | 置换反应都属于氧化还原反应,反应物中的单质一定作还原剂 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

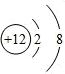 ,A的电子式为
,A的电子式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com