
如图所示,若电解5 min时,测得铜电极的质量增加2.16 g。试回答:

(1)电源中X极是__________(填“正”或“负”)极。
(2)通电5 min时,B中共收集到224 mL(标准状况)气体,溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前[CuSO4]=____________。
(3)若A中KCl溶液的体积也是200 mL,电解后溶液中仍有Cl-,则电解后溶液的pH=
__________。
答案 (1)负 (2)0.025 mol·L-1 (3)13
解析 ①要注意电解的阶段性。如含Cl-的溶液中Cl-电解完后继续通电会使OH-放电,Cu2+在阴极上被电解完全后H+又会放电等。②电极反应式和总反应方程式、电解产物物质的量与得失电子数之间的关系式是电化学计算的主要依据。
(1)铜极增重,说明银在铜极析出,则铜极为阴极,X为负极。
(2)C中铜极增重2.16 g,即析出0.02 mol Ag,线路中通过0.02 mol电子。由4e-~O2,可知B中产生的O2只有0.005 mol,即112 mL。但B中共收集到224 mL气体,说明还有112 mL是H2,即Cu2+全部在阴极放电后,H+接着放电产生了112 mL H2,则通过0.01 mol电子时,Cu2+已被电解完。由2e-~Cu,可知n(Cu2+)=0.005 mol,则:
c(CuSO4)=0.005 mol÷0.2 L=0.025 mol·L-1。
(3)由4e-~4OH-知,A中生成0.02 mol OH-,则:[OH-]=0.1 mol·L-1,pH=13。


科目:高中化学 来源: 题型:
A、B、C、D、E、F为核电荷数依次增大且均小于18的同周期元素。已知A、C、F三原子的最外电子层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水。D元素原子的最外层电子数比次外层少4个,E元素原子次外层电子数比最外层电子数多3个。试回答:
(1)写出元素符号:A________,D________,E________。
(2)用电子式表示B与F形成化合物的过程: ___________________________________。
(3)A、C两元素的最高价氧化物对应水化物相互反应的离子方程式为:
________________________________________________________。
(4)D的固态氧化物为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向_FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是
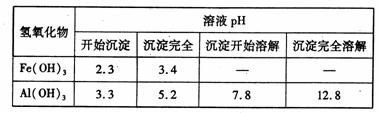
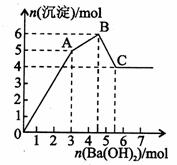
A.据图计算原溶液中c(Cl一)=c(SO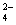 )
)
C.OA段产生的沉淀为BaSO4和Fe(OH)3
B.AB段可能发生的反应是:2SO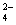 +2Ba2++ Al3+ +30H-= 2BaSO4k +Al(OH)3↓
+2Ba2++ Al3+ +30H-= 2BaSO4k +Al(OH)3↓
D.C点溶液呈碱性的原因是AlO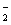 水解,其离子方程式为:AlO
水解,其离子方程式为:AlO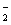 +2H2O=Al(OH)3 +OH一
+2H2O=Al(OH)3 +OH一
查看答案和解析>>
科目:高中化学 来源: 题型:
将煤转化为水煤气的主要化学反应为C(s)+H2O(g)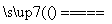 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+ O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:________________________________________________________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图:
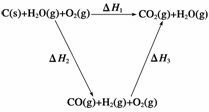
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是__________(填“甲”或“乙”);判断的理由是________________________________________________________________________
________________________________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点:________________________________________________________________________
________________________________________________________________________。
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇 ②甲醛 ③甲酸 ④乙酸。试分析当CO和H2按1∶1的体积比混合反应,合成上述________(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液。通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )

A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活、社会密切相关。下列说法不正确的是 ( )。
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氢氧化钙在水中存在下列溶解过程,当溶解速率等于结晶速率时,有Ca(OH)2(固)Ca2++2OH-。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等,为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,生成物为石膏。
(1)写出下面两个反应的化学方程式:
①SO2与CaCO3悬浊液反应_______________________________________ _________________________________;
②SO2与Ca(OH)2悬浊液反应_____________________________________ ___________________________________。
(2)试说明用熟石灰的悬浊液而不用澄清石灰水来洗涤废气的理由。
查看答案和解析>>
科目:高中化学 来源: 题型:
保护环境是每一个公民的责任。下列说法:①推广使用无磷洗涤剂;②城市生活垃圾分类处理;③推广使用一次性木质筷子;④推广使用清洁能源;⑤过量使用化肥、农药;⑥推广使用无氟冰箱。其中有利于保护环境的是
( )。
A.①②④⑤ B.②③④⑥
C.①②④⑥ D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
世界卫生组织把铝列为食品污染源之一,成人每日摄入铝元素的量应控制在0.004 g以下,油条是中国北方常用的食品之一,每270 g油条中约含0.9 g明矾[KAl(SO4)2·12H2O,其相对分子质量为474]。试通过计算说明,若成人每日食用142.2 g油条,铝元素的摄入量是否会超过安全摄入量?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com