
| A. | c(CH3COO -)>c(CH3COOH) | B. | c(CH3COO -)>c(Na+)>c(H+)>c(OH -) | ||
| C. | c(Na+)=c(CH3COO -)=0.01mol•L-1 | D. | c(CH3COOH)+c(CH3COO -)=0.02mol•L-1 |
分析 物质的量浓度均为0.01mol•L -1的CH3COOH和CH3COONa的混合溶液呈酸性后,则醋酸的电离大于醋酸钠中醋酸根离子的水解,以此来解答.
解答 解:A.醋酸的电离大于醋酸钠中醋酸根离子的水解,即c(CH3COO-)略大于0.01mol/L,c(CH3COOH)略小于0.01mol/L,所以c(CH3COO-)>c(CH3COOH),故A正确;
B.均为0.01mol•L -1的CH3COOH和CH3COONa的混合溶液呈酸性后,醋酸的电离大于醋酸钠中醋酸根离子的水解,溶液显酸性,则c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.c(Na+)=0.01mol/L,而c(CH3COO-)略大于0.01mol/L,故C错误;
D.根据物料守恒可知,均为0.01mol•L -1的CH3COOH和CH3COONa的混合溶液中c(CH3COOH)+c(CH3COO-)=0.02mol•L-1,故D正确;
故选C.
点评 本题考查溶液中离子浓度大小的比较,明确溶液中酸的电离大于盐类的水解是解答本题的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①② | C. | ②④ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
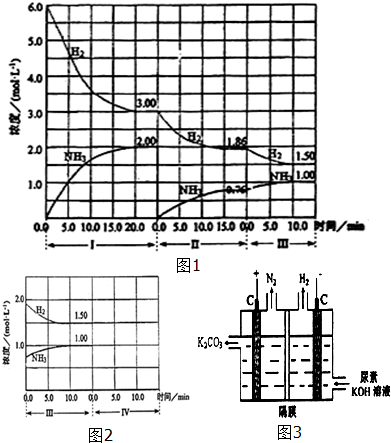
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaHSO4 和 Ba(OH)2 | B. | MgCl2和 NH3•H2O | C. | NaAlO2 和 H2SO4 | D. | AlCl3 和 NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
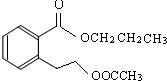 .
.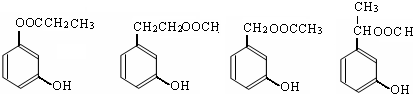 任意2个.
任意2个.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
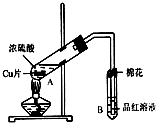 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.| 坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.9g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 与稀H2SO4共热,生成2种有机物 | |
| B. | 该有机物的分子式为C14H10O9 | |
| C. | 常温下,能与NaHCO3溶液反应放出CO2 | |
| D. | 能发生碱性水解反应,1mol该有机物完全反应消耗掉8molNaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com