
【题目】25℃时,NH3H2O的电离平衡常数Kb=1.75×10﹣5 , 该温度下,用0.01molL﹣1盐酸滴定10mLamolL﹣1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( ) 
A.A点溶液中加少量水, ![]() 减小
减小
B.原氨水的物质的量浓度约为1.006×10﹣2mol?L﹣1
C.B,D两点溶液中水电离出来的c(OH﹣):B<0
D.C点溶液中的H2O不发生电离
【答案】B
【解析】解:A、A点溶液中加少量水,促进氨水的电离,在 ![]() 的分子和分母同乘以氢氧根离子的浓度,得
的分子和分母同乘以氢氧根离子的浓度,得 ![]() ,一水合氨的浓度减小,所以
,一水合氨的浓度减小,所以 ![]() 变大,故A错误;B、C点等体积混合溶液呈中性,所以c(Cl﹣)=c(HCl)=c(NH4+)<c(NH3H2O),所以氨水的物质的量浓度约为1.006×10﹣2molL﹣1 , 故B正确;
变大,故A错误;B、C点等体积混合溶液呈中性,所以c(Cl﹣)=c(HCl)=c(NH4+)<c(NH3H2O),所以氨水的物质的量浓度约为1.006×10﹣2molL﹣1 , 故B正确;
C、B点是氨水和氯化氨的混合溶液,对水的电离起抑制作用,水电离出的氢氧根离子等于溶液中的氢离子的浓度10﹣9mol/L,而D点是盐酸和氯化铵的混合物,对水的电离起抑制作用,水电离出的氢氧根离子等于溶液中的氢氧根离子的浓度10﹣9mol/L,所以B、D两点溶液中水电离出来的c(OH﹣):B=D,故C错误;
D、电解质水溶液中都存在水的电离,而不是水不发生电离,只不过电离程度大小不同,故D错误;
故选B.
【考点精析】认真审题,首先需要了解弱电解质在水溶液中的电离平衡(当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理).


科目:高中化学 来源: 题型:
【题目】利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下: SO2(g)+NH3H2O(aq)=NH4HSO3(aq)△H1=a kJmol﹣1
NH3H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l)△H2=b kJmol﹣1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)△H3=c kJmol﹣1
(1)反应2SO2(g)+4NH3H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=kJmol﹣1 .
(2)空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是 . 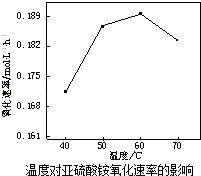
(3)以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用.反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数K= . [已知Ksp(CaCO3)=2.9×10﹣9 , Ksp(CaSO4)=9.1×10﹣6]
(4)(NH4)2SO4在工农业生产中有多种用途. ①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气.该反应的化学方程式为 .
②研究硫酸铵的分解机理有利于对磷石膏的开发.在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示.写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目: .
③(NH4)2SO4是工业制备K2SO4的重要原料.根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路: . 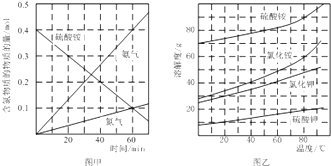
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸钠广泛用作催化剂和稳定合成剂,印染行业的还原剂,还可用于生产保险粉、草酸和甲酸.用电石炉废气(CO75%~90%,以及少量CO2、H2S、N2、CH4等),其合成部分工艺流程如下: 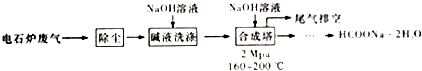
(1)上述工艺用碱液洗涤的目的是 , 可能发生的反应有(列举两利).
(2)上述合成工艺中采用循环喷射吸收合成,其目的是;最后尾气主要成分是 .
(3)合成时,得到的HCOONa溶液溶质质量分数约为5%,合成塔反应液中分离出HCOONa2H2O 的主要步骤有、、过滤,再经洗涤干燥得到.
(4)甲酸钠高温时分解制取草酸钠的化学方程式为 .
(5)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示:向饱和![]() 溶液中逐滴加入稀硫酸,不断搅拌至过量。
溶液中逐滴加入稀硫酸,不断搅拌至过量。
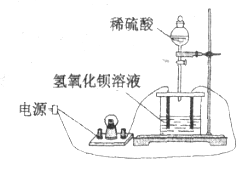
(1)主要的实验现象:烧杯中____________, 灯泡__________________。
(2)烧杯中反应的离子方程式:________________。
(3)下列图示能正确表示实验过程的是___________(填序号)。
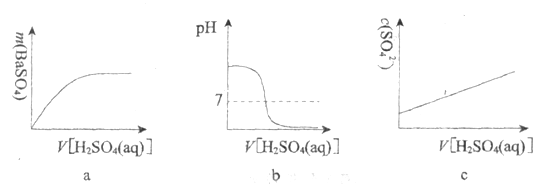
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
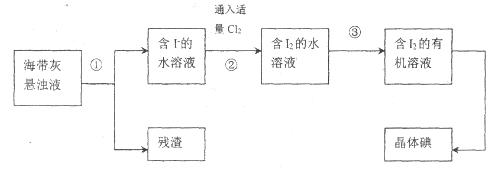
(1)操作③可选用的有机试剂是________(只填一种)。步骤②生成![]() 的离子方程式_______。
的离子方程式_______。
(2)操作过程③可以分解为如下几步:
A.将分液漏斗放在铁架台的铁圈中静置、分层;
B.把50.0 mL碘水和15.0mL所选有机溶剂加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.将漏斗上口玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准,旋开活塞,用烧杯接收液体;
F.从分液漏斗上口倒出上层液体;
(a)过程③正确操作步骤的顺序是(填编号字母)__________;
(b)上述E步操作中“将漏斗上口玻璃塞上的凹槽对准小孔”的目的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组液体混合物:①汽油和氯化钠溶液 ②乙醇与水 ③单质溴和水,分离以上各混合液的正确方法依次是( )
A. 分液、萃取、蒸馏B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Cu、Fe、Cl、O、N是常见的6种元素.
(1)Fe位于元素周期表第周期第族;O的基态原子核外有个未成对电子.Cu的基态原子电子排布式为 .
(2)用“>”或“<”填空:
第一电离能 | 原子半径 | 稳定性 |
NO | CNa | NH3H2O |
(3)液态N2H4与液态N2O4反应生成气态水,在25℃、101kPa下,已知该反应每消耗1mol N2H4放出519.85kJ的热量,该反应的热化学反应方程式是:
(4)古老的但仍是最有用的制备N2H4的方法是NaClO溶液氧化过量的NH3 , 写出该反应的离子方程式,并标出电子转移的方向和数目 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com