
| A. | 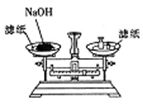 称取一定的NaOH | |
| B. | 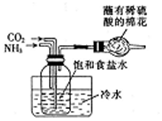 制取Na2CO3 | |
| C. | 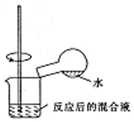 检验浓硫酸与铜反应后的产物中是否含有铜离子 | |
| D. | 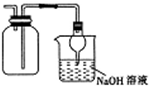 收集NO2并防止其污染环境 |
分析 A.NaOH潮解后具有腐蚀性;
B.氨气、二氧化碳、氯化钠溶液反应生成碳酸氢钠,相同条件下碳酸氢钠的溶解度小;
C.应将密度大的液体注入密度小的液体中;
D.二氧化氮的密度比水大,碱溶液可吸收.
解答 解:A.NaOH潮解后具有腐蚀性,则应在左盘小烧杯中称量,故A错误;
B.NaCl、氨气、二氧化碳反应生成碳酸氢钠和氯化铵,图中装置可制备碳酸氢钠,碳酸氢钠分解生成碳酸钠,过量氨气利用稀硫酸吸收,故B正确;
C.稀释时将密度大的液体注入密度小的液体中,试剂的顺序不合理,故C错误;
D.二氧化氮的密度比空气密度大,则图中导管应长进,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握图中实验装置的作用、物质的制备、气体的收集、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:实验题
 某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:W>Z>X | |
| B. | 单质熔点:W>Z | |
| C. | 最高正价:W>X>Y>Z | |
| D. | W、X、Z最高价氧化物对应的水化物相互之间能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
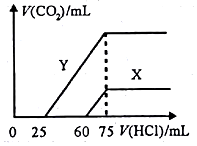 A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大.A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一.请化学用语回答下列问题:
A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大.A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一.请化学用语回答下列问题: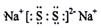 ,写出在空气中长期放置生成H的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2.H的溶液与稀硫酸反应产生的现象为溶液由黄色变为无色,产生浅黄色沉淀和气体产生.
,写出在空气中长期放置生成H的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2.H的溶液与稀硫酸反应产生的现象为溶液由黄色变为无色,产生浅黄色沉淀和气体产生.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=2的硫酸溶液中,由水电离出的H+个数为10-12NA | |
| B. | 标准状况下,1.12L二氯甲烷含氯离子数为0.2NA | |
| C. | 向过量FeI2溶液中通入Cl2,当有1mol Fe2+被氧化时,转移的电子数为3NA | |
| D. | 2molNH3与3molO2在催化剂作用下加热充分反应后,所得NO分子数小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
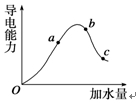 一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题:
一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:Ca(OH)2>Mg(OH)2 | B. | 酸性:H2SO3>H2CO3 | ||
| C. | 热稳定性:NH3<PH3 | D. | 还原性:S2-<Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | X | Y | Z | W |
| 性质 结构 信息 | 工业上常用电解熔融XW2制取X的单质. | Y的最外层电子数比最内层电子数多1. | Z的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂. | W的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强. |
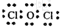 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
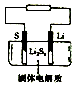 石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )
石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )| A. | 放电时,锂在负极上发生氧化反应 | |
| B. | 放电时,正极的电极反应式为nS+2e-+2Li+=Li2Sn | |
| C. | 充电时,锂电极为阴极,与电源负极相连 | |
| D. | 充电时,理论上阳极失去2mol电子生成32g硫 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com