
【题目】A、B、C和D是同一周期的四种元素,A、B、C的原子序数依次相差1;A元素的单质化学性质最活泼,能与水直接发生反应.B元素的氧化物2.0g恰好跟100mL0.5mol/L的H2SO4完全反应.B元素的单质跟D元素单质反应生成BD2型化合物.根据以上事实回答:
(1)A原子的结构示意图为
(2)C在周期表中的位置:
(3)BD2含有的化学键类型为
(4)A、C两元素最高价氧化物的水化物相互反应的离子方程式为 .
【答案】(1)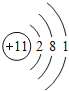 ;
;
(2)
第三周期ⅢA族;
(3)离子键;
(4)Al(OH)3+OH﹣═AlO2﹣+2H2O.
【解析】试题分析:A、B、C、D是同一周期的四种元素,A元素的单质化学性质活泼、能与水直接发生反应,则A处于ⅠA族;
A、B、C的原子序数依次相差为1,则B处于ⅡA族、C处于ⅢA族;
B的氧化物为BO,氧化物BO的物质的量等于硫酸的物质的量=0.1L×0.5mol/L=0.05mol,BO的相对分子质量为:![]() =40g/mol,则B的相对原子质量为:40﹣16=24,则B为Mg元素、故A为Na、C为Al;
=40g/mol,则B的相对原子质量为:40﹣16=24,则B为Mg元素、故A为Na、C为Al;
B元素的单质跟D元素单质反应生成化合物BD2,B为+2价,则D为﹣1价,所以D为Cl元素,结合题目分析解答.
解:、B、C、D是同一周期的四种元素,A元素的单质化学性质活泼、能与水直接发生反应,则A处于ⅠA族;
A、B、C的原子序数依次相差为1,则B处于ⅡA族、C处于ⅢA族;
B的氧化物为BO,氧化物BO的物质的量等于硫酸的物质的量=0.1L×0.5mol/L=0.05mol,BO的相对分子质量为:![]() =40g/mol,则B的相对原子质量为:40﹣16=24,则B为Mg元素、故A为Na、C为Al;
=40g/mol,则B的相对原子质量为:40﹣16=24,则B为Mg元素、故A为Na、C为Al;
B元素的单质跟D元素单质反应生成化合物BD2,B为+2价,则D为﹣1价,所以D为Cl元素,
(1)A为Na,其原子序数为11,最外层含有1个电子,Na的原子结构为: ,故答案为:
,故答案为: ;
;
(2)C是Al元素,其原子核外有3个电子层、最外层电子数是3,所以C位于第三周期第IIIA族,
故答案为:第三周期ⅢA族;
(3)MgCl2中镁离子和氯离子只存在离子键,故答案为:离子键;
(4)A、C两元素最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH﹣═AlO2﹣+2H2O,
故答案为:Al(OH)3+OH﹣═AlO2﹣+2H2O.


科目:高中化学 来源: 题型:
【题目】氰化钠是一种重要的化工原料。泄漏时会导致环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理。
(1)NaCN的电子式为_______。
(2)NaCN与双氧水反应为:NaCN+H2O2+H2O=NaHCO3+NH3↑,用H2O2处理1molNaCN时,反应中转移电子的物质的量为______mol。
(3)NaCN也能被酸性高锰酸钾溶液氧化,产生对大气无污染的气体和Mn2+,该反应的离子方程式是____________。
(4)某化学兴趣小组在实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
I.实验室通过下图装置制备Na2S2O3。
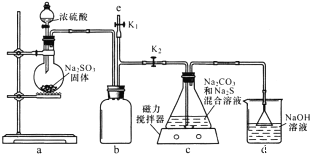
①装置中盛浓硫酸的仪器是_____,b装置的作用是________________。
②c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有____________。
③实验结束后,在e处最好连接盛NaOH溶液的容器,再________________(填具体操作),最防止拆除装置时污染空气。
Ⅱ.测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50 mg/L。
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
③实验如下:取15.00 mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000 ×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
④滴定终点的判断方法是_______________。
(7)经计算处理后的废水中NaCN的浓度为________mg/L(保留两位小数),处理后的废水是否达到排放标准____________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行氯化亚铁与氧气反应的探究。已知氯化亚铁的熔点674℃、沸点1023℃;三氯化铁在300℃以上易升华,易溶于水并且有强烈的吸水性。在500℃条件下氯化亚铁与氧气可能发生多种反应,反应之一为:12FeCl2 +3O2![]() 2Fe2O3 +8FeCl3。回答下列问题:
2Fe2O3 +8FeCl3。回答下列问题:
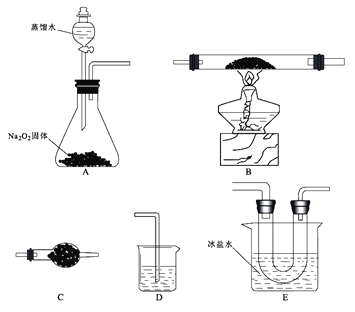
(1)仪器C的名称____________,连接好装置后,加入药品前的操作为___________________。
(2)E装置的作用是______________。
(3)反应过程发现,装置B中除生成红棕色固体外,还观察到黄绿色气体,生成该气体的化学方程式为_____________________________。
(4)待B中充分反应后,停止加热,仍继续通入氧气直至反应管冷却。则停止加热前是否需要先将D中导管口移出水面,为什么?
_____________________________。
(5)设计实验:
①利用E装置U形管里的固体验证Fe(OH)3是弱碱:___________________。(简明扼要写方法)
②利用E装置U形管里的固体,配成溶液,制得某种胶体,写出制备该胶体的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大。

(1)W位于元素周期表中第 周期第 族画出X的阴离子的结构示意图 。
(2)Z的氢化物和溴化氢相比,较稳定的是 (写化学式);Z的氢化物与氟化氢相比,沸点较高的是 (写化学式)。
(3)Y的金属性与Mg的金属性相比, (写化学式)的金属性强,请用实验证明它们金属性的相对强弱: 。
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛。
(1)根据下图写出合成氨的热化学方程式是________________________。

(2)将1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___________(填“大于”、“等于”或“小于”)92.2 kJ,原因是______________;若加入催化剂,ΔH________(填“变大”、“不变”或“变小”)。
(3)已知分别破坏1 mol N≡N键、1 mol H-H键时需要吸收的能量为946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为________kJ。
(4)N2H4可视为NH3分子中的H被-NH2取代的产物。发射卫星时以N2H4(g)为燃料、NO2为氧化剂,二者反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)==2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)==N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
则1 mol N2H4与NO2完全反应的热化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2015·江苏化学,14,4分)室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A.向0.10 mol·L-1 NH4HCO3溶液中通CO2:c(NH![]() )=c(HCO
)=c(HCO![]() )+c(CO
)+c(CO![]() )
)
B.向0.10 mol·L-1 NaHSO3溶液中通NH3:c(Na+)>c(NH![]() )>c(SO
)>c(SO![]() )
)
C.向0.10 mol·L-1 Na2SO3溶液中通SO2:c(Na+)=2[c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO3)]
)+c(H2SO3)]
D.向0.10 mol·L-1 CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016·江苏化学,13,4分)根据下列实验操作和现象所得到的结论正确的是(双选)( )
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1 mol·L-1Na2SO3溶液的pH约为10;0.1mol·L-1NaHSO3溶液的pH约为5。 | HSO |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某分子的球棍模型如下图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )
![]()
A.X原子可能为第ⅤA族元素
B.Y原子一定为第ⅠA族元素
C.该分子中既含有极性共价键又含有非极性共价键
D.从圆球的大小分析,该分子可能为N2F4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d四个金属电极,有关的实验装置、部分实验现象如下:
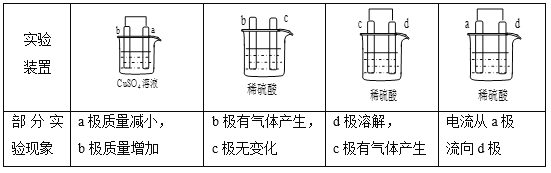
由此可判断这四种金属的活动性顺序是
A. a>b>c>d B. d>a>b>c C. b>c>d>a D. a>b>d>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com