
 将此反应设计成原电池,若电解质溶液为H2SO4,
将此反应设计成原电池,若电解质溶液为H2SO4,

科目:高中化学 来源:不详 题型:单选题

| A.若两电极都是金属,则它们的活动性顺序为:X>Y |
| B.外电路的电流方向是:X→外电路→Y |
| C.若两电极分别为锌棒和石墨棒,则X为石墨 |
| D.Y极上发生的是氧化反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a>b>c>d | B.a>c>d>b | C.c>a>b>d | D.b>d>c>a |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
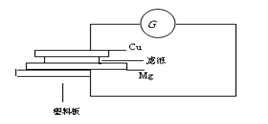
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
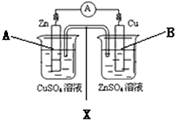
| A.若X是盐桥,则上述装置可以形成原电池 |
| B.若X是铜条,则上述装置不发生任何反应 |
| C.若X是铜条,上述装置中,B电极是阴极 |
| D.若X是铜条,上述装置中,A电极的电极反应式是:Cu2+ + 2e-=Cu |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
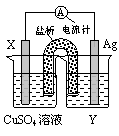
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.Mg比Al活泼,Mg 失去电子被氧化成Mg2+ |
| B.负极反应式为:Al+4OH--3e-=AlO2-+2H2O |
| C.该电池的内外电路中,电流均是由电子定向移动形成的 |
| D.Al是电池阴极,开始工作时溶液中会立即有白色沉淀析出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Zn ∣H2SO4(稀)∣Fe | B.Cu ∣ AgNO3(aq)∣ Ag |
| C.Zn ∣ CCl4∣ Cu | D.Fe ∣ H2SO4(稀) ∣ Fe |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在使用过程中,电池负极区溶液的碱性增强 |
| B.使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C.Zn是负极,Ag2O是正极 |
| D.Zn电极发生还原反应,Ag2O电极发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com