
分析 当加入一种淡黄色粉末状固体物质时,有刺激性气味的混和气体放出,同时生成白色沉淀,说明溶液中一定不含有Cu2+、Fe2+,淡黄色固体粉末为过氧化钠,与水反应生成氢氧化钠和氧气,刺激性气味的混合气体为NH3和O2,说明含有NH4+,当加入0.4mol淡黄色粉末时,共收集到0.4mol混合气体,结合2Na2O2+2H2O=4NaOH+O2↑、OH-+NH4+=NH3•H2O,生成氧气为0.2mol,生成氨气为0.2mol,可知NH4+为0.2mol,生成沉淀时消耗氢氧化钠物质的量为0.8mol-0.2mol=0.6mol,且此时生成的沉淀最多.此后继续加入淡黄色粉末时,沉淀量逐渐减少,至加入0.45mol粉末后,沉淀量由0.25mol减少至0.15mol,证明一定含有Al3+,说明溶液中一定不含有OH-,且Al3+物质的量为0.1mol,生成1molAl(OH)3需要3molNaOH,沉淀量由0.25mol减少至0.15mol,剩余的氢氧化钠为0.3mol,生成沉淀为0.15mol,说明沉淀为二价金属离子形成的沉淀为Mg(OH)2,溶解1molAl(OH)3,Al(OH)3+OH-=AlO2-+2H2O,需要1molNaOH,再加入0.05mol过氧化钠反应生成1mol氢氧化钠,再加入粉末后,沉淀就不再减少,综上所述,溶液中一定含有Mg2+、Al3+、NH4+,一定不含有OH-、Cu2+、Fe2+,由电荷守恒可知,一定含阴离子为SO42-,不能确定是否含K+,以此来解答.
解答 解:(1)溶液中一定含有Mg2+、Al3+、NH4+、SO42-,一定不含有OH-、Cu2+、Fe2+,不能确定是否含K+,
故答案为:Mg2+、Al3+、NH4+、SO42-;Cu2+、Fe2+、OH-;K+;
(2)淡黄粉末与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(3)由上述分析可知,溶液中阳离子的物质量之比为n(Mg2+):n(Al3+):n(NH4+)=0.15mol:0.1mol:0.2mol=3:2:4,
故答案为:n(Mg2+):n(Al3+):n(NH4+)=3:2:4.
点评 本题考查无机物的推断,为高频考点,把握发生的反应、离子共存、元素化合物知识为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(N)>r(M)>r(Y)>r(X) | |
| B. | X与Y形成的化合物溶于水,溶液显碱性 | |
| C. | 简单气态氢化物的热稳定性:M>N>X | |
| D. | 单质的熔点:Y>N>M>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
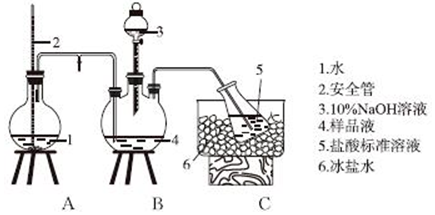
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
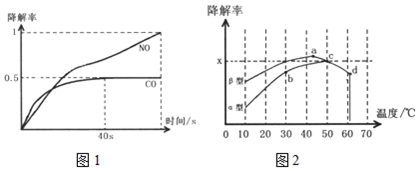
 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-一定存在 | |
| B. | CO32-和SO42-一定存在,且二者的个数比为1:2 | |
| C. | Zn2+和Ca2+一定不存在 | |
| D. | 100mL溶液中K+的质量不小于2.34g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径简单最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
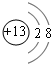 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
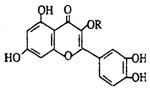
| A. | 可溶于有机溶剂 | B. | 分子中有三个苯环 | ||
| C. | 1mol维生素P可以和6molBr2反应 | D. | 1mol维生素P可以和4molNaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com