
”¾ĢāÄæ”潫m1gĶĀĮŗĻ½šĶ¶Čėµ½1 Lŗ¬H2SO4ŗĶHNO3µÄ»ģŗĻČÜŅŗÖŠ£¬ŗĻ½šĶźČ«Čܽāŗóֻɜ³ÉVL ”ŖŃõ»ÆµŖĘųĢå£Ø±ź×¼×“æö£©£¬Ļņ·“Ó¦ŗóµÄČÜŅŗÖŠÖšµĪ¼ÓČė1mol/L NaOHČÜŅŗ£¬Éś³É³ĮµķµÄÖŹĮæÓėĖł¼ÓNaOHČÜŅŗµÄĢå»żµÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÖŠ²»ÕżČ·µÄŹĒ£ŗ
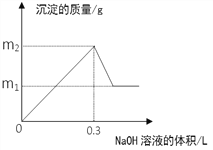
A. 2c(H2SO4) + c(HNO3) = 0.8 mol”¤L-1
B. m2”Ŗm1=5.1
C. ŌŗĻ½šÖŠĀĮµÄÖŹĮæ·ÖŹżĪŖ34.7%
D. V = 2.24
”¾“š°ø”æA
”¾½āĪö”æÉčĶŗĶĀĮµÄĪļÖŹµÄĮæ·Ö±šĪŖx”¢y£¬øł¾ŻĶŗĶĀĮµÄÖŹĮæµČÓŚĒāŃõ»ÆĶµÄÖŹĮæÓŠ£ŗ64x+27y=98x£¬øÕ¼ÓČėĒāŃõ»ÆÄĘ¼“²śÉś³Įµķ£¬ĖµĆ÷ČÜŅŗ֊ƻӊH+Ź£Óą£¬øł¾ŻĶĄė×Ó”¢ĀĮĄė×ÓĻūŗĵÄĒāŃõøłĄė×ÓÖ®¼äµÄ¹ŲĻµÓŠ2x+3y=0.3£¬½āµĆx=2.7/52mol£¬y=1.7/26mol”£½šŹōÓėĻõĖįŗĶĮņĖįµÄ»ģŗĻĖį·“Ó¦Ź±µÄ¼ĘĖćÓ¦ŅŌĄė×Ó·½³ĢŹ½¼ĘĖć£¬øł¾Ż3Cu+8H ++2NO3-=3Cu2++2NO”ü+4H2OæÉÖŖCuĻūŗĵÄĒāĄė×ÓµÄĪļÖŹµÄĮæĪŖ8x/3£¬øł¾ŻAl+4H ++NO3-=Al3++NO”ü+2H2OæÉÖŖAlĻūŗĵÄĒāĄė×ÓµÄĪļÖŹµÄĮæĪŖ4y£¬ĖłŅŌŌ»ģŗĻČÜŅŗÖŠĖłÓŠĒāĄė×ÓµÄĪļÖŹµÄĮæĪŖ4y+8x/3=0.4mol£¬ĖłŅŌŌ»ģŗĻĖįÖŠĒāĄė×ÓµÄ×ܵÄĪļÖŹµÄĮæÅضČĪŖ0.4mol/L£¬¹Ź2c(H2SO4) + c(HNO3) = 0.4mol”¤L-1£¬A“ķĪó£»Cu(OH)2”¢Al(OH)3Į½ÖÖ³ĮµķµÄÖŹĮæµČÓŚ½šŹōµÄÖŹĮæ¼ÓÉĻMg2+ŗĶAl3+Ėł½įŗĻµÄOH-µÄÖŹĮ棬½įŗĻµÄOH-µÄĪļÖŹµÄĮæĪŖ0.3mol£¬ĖłŅŌm2=m1+0.3”Į17g=m1+5.1g£¬ĖłŅŌm2”Ŗm1=5.1£¬BÕżČ·£»ŅņĪŖ»ģŗĻ½šŹōCuŗĶAlµÄÖŹĮæµČÓŚCu(OH)2µÄÖŹĮ棬ĖłŅŌŌŗĻ½šÖŠĀĮµÄÖŹĮæ·ÖŹżµČÓŚCu(OH)2ÖŠOH-µÄÖŹĮæ·ÖŹżĪŖ34”Ā98”Į100%=34.7%£¬CÕżČ·£»øł¾ŻµĆŹ§µē×ÓŹŲŗćæÉÖŖ£¬»ģŗĻ½šŹōŹ§Č„µÄµē×ÓµÄĪļÖŹµÄĮæĪŖ2x+3y=0.3mol£¬HNO3ÖŠµÄNŌŖĖŲ“Ó+5¼Ū½µµĶµ½+2¼Ū£¬ĖłŅŌÉś³ÉµÄNOµÄĪļÖŹµÄĮæĪŖ0.3/3=0.1mol£¬¹Ź±ź×¼×“æöĻĀĘäĢå»żĪŖ2.24L£¬D ÕżČ·”£¹ŹÕżČ·µÄ“š°øĪŖA”£


 Ö„ĀéæŖ»ØæĪ³ĢŠĀĢåŃéĻµĮŠ“š°ø
Ö„ĀéæŖ»ØæĪ³ĢŠĀĢåŃéĻµĮŠ“š°ø ŌõѳѧŗĆÅ£½ņÓ¢ÓļĻµĮŠ“š°ø
ŌõѳѧŗĆÅ£½ņÓ¢ÓļĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŹµŃéŹŅ½öÓŠČēĻĀŅĒĘ÷»ņÓĆĘ·£ŗÉÕ±”¢Ģś¼ÜĢØ”¢ĢśČ¦”¢Čż½Å¼Ü”¢Ā©¶·”¢·ÖŅŗĀ©¶·”¢ŹÆĆŽĶų”¢¾Ę¾«µĘ”¢²£Į§°ō”¢ĮæĶ²”¢Õō·¢Ćó”¢Ō²µ×ÉÕĘ攢»š²ń”£“Óȱ·¦ŅĒĘ÷»ņÓĆĘ·µÄ½Ē¶Čæ“£¬²»ÄܽųŠŠµÄŹµŃéĻīÄæŹĒ(””””)
A.Õō·¢
B.ŻĶČ”
C.ŅŗĢå¹żĀĖ
D.Éż»Ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹµÄ·ÖĄąŗĻĄķµÄŹĒ(””””)
A. Ńõ»ÆĪļ£ŗCO2”¢NO”¢SO2”¢H2O B. ¼ī£ŗNaOH”¢KOH”¢Ba(OH)2”¢Na2CO3
C. ļ§ŃĪ£ŗNH4Cl”¢NH4NO3”¢NH3”¤H2O D. ¼īŠŌŃõ»ÆĪļ£ŗNa2O”¢CaO”¢CO2”¢Al2O3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŗ¬øõ»ÆŗĻĪļµÄ·ĻĖ®ÓŠ¶¾£¬ĢŲ±šŹĒCr£Ø¢ö£©ÓŠÖĀ°©×÷ÓĆ£¬¶ŌÅ©×÷Īļ¼°Ī¢ÉśĪļµÄ¶¾ŗ¦ŗÜ“ó£®ÄæĒ°“¦ĄķµÄ·½·Ø½Ļ¶ą£¬»¹Ō³Įµķ·ØŹĒ½ĻĪŖ¹ć·ŗµÄ“¦Ąķŗ¬øõ·ĻĖ®µÄ·½·Ø£¬Į÷³ĢČēĶ¼£ŗ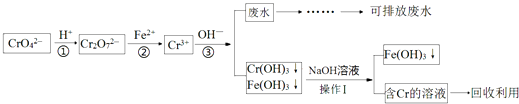
£Ø1£©²½Öč¢ŁÖŠ“ęŌŚĘ½ŗā£ŗ2CrO42©£Ø»ĘÉ«£©+2H+Cr2O72©£Ø³ČÉ«£©+H2OøĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½K=£»¼īŠŌČÜŅŗÖŠCr£Ø¢ö£©Ąė×ÓµÄŃÕÉ«³Ź £® £ØĢī”°»ĘÉ«”±»ņ”°³ČÉ«”±£©
£Ø2£©ÉĻŹö²Ł×÷¢ńµÄĆū³ĘĪŖ £¬ ŅŌĻĀĪļÖŹæÉÓĆÓŚ“śĢę²½Öč¢ŚÖŠµÄFe2+µÄŹĒ
A£®KMnO4£ØH+£© B£®HNO3 C£®Na2SO3
£Ø3£©²½Öč¢ŪÖŠ³öĖ®×ÜøõÓėČÜŅŗµÄpH¹ŲĻµČēĶ¼£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ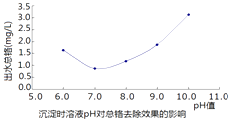
A.ĪŖÓŠŠ§³żČ„Cr3+ £¬ ¼ÓČėµÄ¼īŌ½¶ąŌ½ŗĆ
B.Cr£ØOH£©3æÉČÜÓŚĒæ¼ī
C.ŅŖ³żČ„Cr3+ £¬ µ÷½ŚpHÖµ×īŗĆĪŖ7×óÓŅ
£Ø4£©ŅŃÖŖKsp[Cr£ØOH£©3]=1.1”Į10©32 £¬ °“”¶ĪŪĖ®×ŪŗĻÅŷűź×¼”·£¬Ė®ÖŹÖŠ×ÜøõµÄÅضČÓ¦Š”ÓŚ3”Į10©5molL©1 £¬ µ±²½Öč¢Ūµ÷½ŚpH=6Ź±£¬øĆ“¦ĄķŗóµÄĪŪĖ®ŹĒ·ń“ļµ½Åŷűź×¼£æ£ØĢī”°ŹĒ”±»ņ”°·ń”±£©£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
A.Õż¶”ĶéµÄ·Šµć±ČŅģ¶”ĶéµÄøß
B.¼×Ķ锢±½”¢ĘĻĢŃĢĒ¾ł²»ÄÜŹ¹äåĖ®»ņĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«
C.ŃņĆ«”¢²ĻĖ攢ĖÜĮĻ”¢ŗĻ³ÉĻš½ŗ¶¼ŠŌŹōÓŚÓŠ»śøß·Ö×Ó²ÄĮĻ
D.ĢģČ»Ö²ĪļÓĶƻӊŗć¶ØµÄČŪ·Šµć£¬³£ĪĀĻĀÄŃČÜÓŚĖ®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æCaCO3µÄĦ¶ūÖŹĮæĪŖ100g/mol£¬½«5.0g CaCO3¹ĢĢåĶźČ«ČÜÓŚĻ”ŃĪĖįŗó£¬ŌŁÓĆÕōĮóĖ®Ļ”ŹĶ³É100mLČÜŅŗ£®øĆČÜŅŗÖŠCa2+ µÄĪļÖŹµÄĮæÅضČĪŖ( )
A. 5.0 mol/L B. 0.50 mol/L C. 1.0 mol/L D. 0.10 mol/L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø £©
A.NH4+”¢Al3+”¢Cl©”¢HCO3©ŌŚČÜŅŗÖŠÄÜ“óĮæ¹²“ę
B.H2O2µÄµē×ÓŹ½ŹĒ£ŗ ![]()
C.AlCl3ČÜŅŗÖŠ¼ÓČė¹żĮæµÄ°±Ė®£ŗAl3++3NH3H2OØTAl£ØOH£©3”ż+3NH4+
D.ĢśŠāŹĒ»ÆŗĻĪļ£¬æÉÓĆFe2O3nH2O£Ø2£¼n£¼3£©±ķŹ¾
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµŖ¼°Ęä»ÆŗĻĪļŌŚ¹¤Å©ŅµÉś²ś”¢Éś»īÖŠÓŠ×ÅÖŲŅŖ×÷ÓĆ£®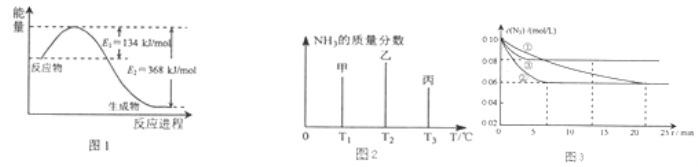
£Ø1£©Ķ¼1ŹĒ1molNO2ŗĶ1mol CO·“Ӧɜ³ÉCO2ŗĶNO¹ż³ĢÖŠÄÜĮæ±ä»ÆŹ¾ŅāĶ¼£¬ĒėŠ“³öNO2ŗĶCO·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ £®
£Ø2£©ŌŚ¹Ģ¶ØČŻ»żµÄĆܱÕČŻĘ÷ÖŠ£¬½ųŠŠČēĻĀ»Æѧ·“Ó¦£ŗN2£Øg£©+3H2£Øg£©2NH3£Øg£©”÷H=©92.4kJmol©1 ÓĆŅ»¶ØĪļÖŹµÄĮæµÄN2ŗĶH2ŗĻ³ÉNH3 £¬ ČżøöČŻĘ÷µÄ·“Ó¦ĪĀ¶Č·Ö±šĪŖT1”¢T2”¢T3ĒŅŗć¶Ø²»±ä£¬ŌŚĘäĖüĢõ¼žĻąĶ¬µÄĒéæöĻĀ£¬ŹµŃé²āµĆ·“Ó¦¾ł½ųŠŠµ½t minŹ±NH3µÄÖŹĮæ·ÖŹżČēĶ¼2ĖłŹ¾£ŗ
“ĖŹ±¼×”¢ŅŅ”¢±ūČżøöČŻĘ÷ÖŠŅ»¶Ø“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒČŻĘ÷£¬¶¼“ļµ½Ę½ŗāדĢ¬Ź±£¬NH3µÄÖŹĮæ·ÖŹż×īøߵďĒČŻĘ÷£ØĢī¼×”¢ŅŅ”¢±ū£©£®
Ķ¼3ŹĒŹµŃéŹŅŌŚČżøö²»Ķ¬Ģõ¼žµÄĆܱÕČŻĘ÷ÖŠ£¬·Ö±š¼ÓČėÅØ¶Č¾łĪŖc£ØN2£©=0.10mol/L£¬c£ØH2£©=0.26mol/L½ųŠŠ·“Ó¦Ź±£¬N2µÄÅضČĖꏱ¼äµÄ±ä»ÆČēĶ¼¢Ł”¢¢Ś”¢¢ŪĒśĻßĖłŹ¾£®
¢ńøĆ·“Ó¦ŹµŃé¢ŚĘ½ŗāŹ±H2µÄ×Ŗ»ÆĀŹĪŖ £®
¢ņ¾ŻĶ¼3ĖłŹ¾£¬¢Ś×°ÖĆÖŠÓŠŅ»øöĢõ¼žÓė¢Ł²»Ķ¬£¬ĒėÖø³ö¢ŚĻą¶Ō¢ŁøıäµÄĢõ¼ž £®
¢ó¼ĘĖ揵Ńé¢ŪµÄĘ½ŗā³£ŹżĪŖ £®
£Ø3£©ĶÓėŅ»¶ØÅضČĻõĖį·“Ó¦Ź±·½³ĢŹ½æɱķŹ¾ĪŖ£ŗCu+HNO3Ņ»Cu£ØNO3£©2+NO+NO2+H2O£Ø·½³ĢŹ½Ī“ÅäĘ½£©£®3.2g Cu±»ĻõĖįĶźČ«Čܽāŗó£¬Čē¹ūµĆµ½µÄNOŗĶNO2ĪļÖŹµÄĮæĻąĶ¬£¬ŌņµĆµ½±ź×¼×“æöĻĀNOĢå»żĪŖ L£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŹµŃéŹŅĄļ½ųŠŠ·ÖŅŗ²Ł×÷£¬ĻĀĮŠŹµŃéŅĒĘ÷Ņ»¶ØÓĆ²»×ÅµÄŹĒ (””””)
A.׶ŠĪĘæ
B.·ÖŅŗĀ©¶·
C.²£Į§°ō
D.ĪĀ¶Č¼Ę
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com