
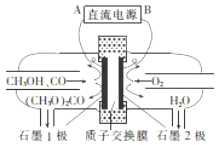
 碳酸二甲酯[(CH3O)2CO]是一种具有发展前景的“绿色”化工产品,电化学合成碳酸二甲酯的工作原理如图所示(加入两极的物质均是常温常压下的物质).下列说法正确的是( )
碳酸二甲酯[(CH3O)2CO]是一种具有发展前景的“绿色”化工产品,电化学合成碳酸二甲酯的工作原理如图所示(加入两极的物质均是常温常压下的物质).下列说法正确的是( )| A. | 电解一段时间后,阴极和阳极消耗的气体的物质的量之比为l:2 | |
| B. | 石墨l极发生的电极反应为2CH3OH+CO-e-═(CH3O)2CO+H+ | |
| C. | 石墨2极与直流电源正极相连 | |
| D. | H+由石墨2极通过质子交换膜向石墨l极移动 |
分析 该装置有外接电源,是电解池,由图可知甲醇和一氧化碳失电子发生氧化反应生成碳酸二甲酯,则电极石墨1为阳极,阳极反应为2CH3OH+CO-2e-═(CH3O)2CO+2H+,电极石墨2为阴极,阳极产生的氢离子从从质子交换通过移向阴极,氧气在阴极得电子与氢离子反应生成水,电极反应为O2+4e-+4H+=2H2O,据此解答.
解答 解:A.常温常压下甲醇是液体,电解池工作时转移电子守恒,根据关系式2CO~4e-~O2可知阴极消耗的氧气与阳极消耗的一氧化碳物质的量之比为1:2,故A正确;
B.阳极上是甲醇和一氧化碳反应失电子发生氧化反应,电极反应为2CH3OH+CO-2e-=(CH3O)2CO+2H+,故B错误;
C.石墨2为阴极,阴极与电源的负极相连,故C错误;
D.阳离子移向阴极,则氢离子由石墨1极通过质子交换膜向石墨2极移动,故D错误;
故选A.
点评 本题考查电解池综合知识的应用,为高频考点,侧重于电解池工作原理的考查,注意把握电极反应的判断,把握电极方程式的书写,为解答该类题目的关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸有气体生成,将气体通入澄清石灰水中溶液变浑浊,则溶液中一定有CO32- | |
| B. | 加入BaCl2溶液有白色沉淀生成,再加盐酸,沉淀不消失,则溶液中一定有SO42- | |
| C. | 加入浓氢氧化钠溶液并加热,生成的气体能使湿润的红色石蕊试纸变蓝,则溶液中一定含有NH4+ | |
| D. | 加入碳酸钠溶液生成白色沉淀,再加盐酸白色沉淀消失,则溶液中一定含有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 分别进行的实验 | 现象 |
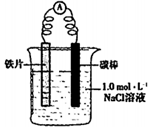 | i.连好装置 一段时间后,向烧杯中滴加酚酞 | 碳棒附近溶液变红 |
| ii.连好装置 一段时间后,向烧杯中滴加[K3[Fe(CN)6] | 铁片表面产生蓝色沉淀 |
| 实验 | 滴加 | 试管 | 现象 |
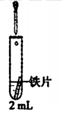 | 0.5mol.LK3[Fe(CN)6]溶液 | iii.蒸馏水 | 无明显变化 |
| iv.1.0mol•L-1NaCl溶液 | 铁片表面产生大量蓝色沉淀 | ||
| v.0.5mol•L-1Na2SO4溶液 | 无明显变化 |
| 实验 | 试剂 | 现象 |
| A | 酸洗后的铁片K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
| B | 酸洗后的铁片K3[Fe(CN)6]和NaCl混合溶液(未除O2) | 产生蓝色沉淀 |
| C | 铁片K3[Fe(CN)6]和NaCl混合溶液(已除O2) | 产生蓝色沉淀 |
| D | 铁片K3[Fe(CN)6]和盐酸混合溶液(已除O2) | 产生蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
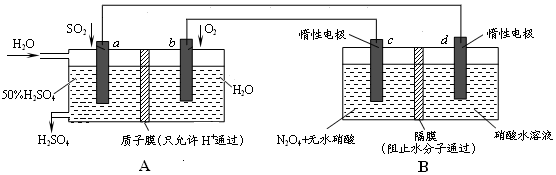
| A. | A是原电池,B是电解池 | |
| B. | 同温同压下,a电极消耗气体和d电极产生气体体积相等 | |
| C. | 当电路中通过2mole-,A、B中各有2molH+通过隔膜,但移动方向相反 | |
| D. | c电极的电极反应方程式为:N2O4+2HNO3-2e-═2N2O5+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 含氯苯(
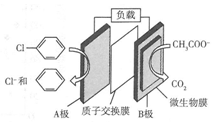
含氯苯(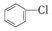 )的废水可通过加入适量乙酸钠,设计成微生物电池将氯苯转化为苯而除去,其除去原理如图所示,下列叙述正确的是( )
)的废水可通过加入适量乙酸钠,设计成微生物电池将氯苯转化为苯而除去,其除去原理如图所示,下列叙述正确的是( )| A. | A极为负极,发生氧化反应 | B. | H+由A极穿过质子交换膜到达B极 | ||
| C. | A 极电极反应式为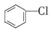 +2e-+H+=Cl-+ +2e-+H+=Cl-+ | D. | 反应后电解液的pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
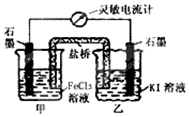 控制合适的条件,KI溶液过量,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列判断正确的是( )
控制合适的条件,KI溶液过量,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列判断正确的是( )| A. | 反应开始时,甲中石墨电极上Fe3+发生氧化反应 | |
| B. | 反应开始时,乙中石墨电极的反应式:I2+2e-═2I- | |
| C. | 电流计读数为零时,在甲中加入KSCN溶液,出现红色 | |
| D. | 电流计读数为零时,反应处在停止状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
| B | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中一定有SO42- |
| C | 向10mL 0.2mol/LNaOH溶液中先滴入2滴0.1mol/LMgCl2溶液,再滴加2滴0.1mol/LFeCl3溶液 | 先有白色沉淀生成,加入FeCl3溶液后,又有红褐色沉淀生成 | 在相同的温度下的Ksp:Mg(OH)2>Fe(OH)3 |
| D | 滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中一定无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6和C3H8不存在同分异构体,CH2O和C2H4O2互为同系物 | |
| B. | 一定条件下,乙烯、乙酸乙酯和淀粉都能与水反应 | |
| C. | 乙烯和苯分子中都含有碳碳双键,都能使溴水褪色 | |
| D. | 糖类、油脂和蛋白质都能发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com