
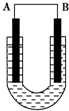
 把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红.填空完成问题:
把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红.填空完成问题:分析 该原电池中,Fe易失电子发生氧化反应而作负极,Cu作正极,正极上氧气得电子发生还原反应生成氢氧根离子,酚酞遇碱变红色,据此分析解答.
解答 解:①正极附近生成氢氧根离子,酚酞遇碱变红色,在A极观察到酚酞变红,说明A为正极,则A为金属铜;
故答案为:正;铜;
②该原电池中,Fe易失电子发生氧化反应而作负极,电极反应式为:Fe-2e-=Fe2+,Cu作正极,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-=40H-,正极附近生成氢氧根离子,两电极反应式相加即为总反应2Fe+O2+2H2O═2Fe(OH)2,
故答案为:O2+2H2O+4e-═4OH-;2Fe+O2+2H2O═2Fe(OH)2.
点评 本题考查了原电池原理的应用,注意把握原电池中正负极的判断和电极方程式的书写,注意根据现象分析判断,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | 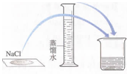 |  | 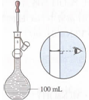 |
| A.接近称量质量时,轻振手腕,加够药品 | B.溶解时,用量筒控制所加蒸馏水的量 | C.移液时,玻璃棒插在刻度线以上,防止液体洒出 | D.接近刻度线1~2 cm时,用胶头滴管滴加蒸馏水至刻度线 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
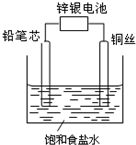 锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.锌银电池电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:
锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.锌银电池电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某气体$\stackrel{通入品红溶液中}{→}$品红溶液褪色 结论:某气体一定是SO2 | |
| B. | 某气体$\stackrel{通入澄清石灰水}{→}$ 产生白色沉淀 结论:某气体一定是CO2 | |
| C. | 某溶液$\stackrel{打开瓶盖}{→}$冒白雾$\stackrel{将沾有浓氨水的玻璃棒靠近}{→}$ 白烟 结论:原溶液一定是浓盐酸 | |
| D. | 某溶液$\stackrel{滴加KSCN溶液液}{→}$ 血红色溶液 结论:原溶液中一定含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积等物质的量浓度的Na2CO3和Na2SO4溶液,Na2SO4溶液中的离子总数多于Na2CO3溶液 | |
| B. | 相同温度下,pH相等的NaHCO3溶液、NaClO溶液、NaOH溶液:c(NaClO)>c(NaHCO3)>c(NaOH) | |
| C. | 常温下,CH3COONa与HCl溶液混合所得中性溶液:c(Na+)=c(Cl-)>c(H+)=c(OH一) | |
| D. | 0.1 mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 | |
| B. | 转移溶液前容量瓶内有少量蒸馏水 | |
| C. | 定容时,俯视容量瓶的刻度线 | |
| D. | 定容摇匀时,发现液面降低,又补加少量水,重新达到刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com