
| A. | BaSO4溶于水的部分能够电离,所以BaSO4是电解质 | |
| B. | SO2的水溶液能够导电,所以SO2是电解质 | |
| C. | 液态Cl2不导电,所以Cl2是非电解质 | |
| D. | 盐酸能导电,所以盐酸是电解质 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 350 | 54.0 | a | b |
| 415 | c | 40.0 | d |
| 550 | e | f | 36.0 |
| A. | b>e | B. | 415℃、2.0MPa时B的转化率为60% | ||
| C. | 该反应的△H>0 | D. | 平衡常数K(550℃)>K(350℃) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验目的 | 方法及操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| ④ | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液 |
| ⑤ | 判断不同反应的反应速率的大小 | 比较不同反应的反应热数据的大小 |
| A. | ①②④ | B. | ②③④ | C. | ①③④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁变为镁离子时所含电子数为NA | |
| B. | 1mol•L-1的A1Cl3溶液中,Cl-离子的数目为3NA | |
| C. | 标准状况下,22.4LSO3含有的分子数为NA | |
| D. | 常温常压下,16g O2和O3的混合气体所含分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.
元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、ClO-、Cl- | B. | Na+、NH4+、Cl- | C. | Mg2+、Cl-、Fe2+ | D. | Mg2+、Ba2+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
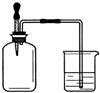 如右图所示,集气瓶 内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )
如右图所示,集气瓶 内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )| A. | ①② | B. | ②④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com