
| A、同温度同物质的量浓度时,HF比HCN电离平衡常数大,则NaF溶液的pH比NaCN溶液大 |
| B、0.2 mol?L-1 NH4Cl和0.1 mol?L-1 NaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| D、同浓度的下列溶液中,①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4 ④NH3?H2O;c(NH4+) 由大到小的顺序是:③>②>①>④ |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
| A、烟花爆竹爆炸不易使用水来灭火,可用干沙 | ||||
| B、烟花爆竹的燃放产生大量污染气体,应加以限制 | ||||
| C、烟花爆竹燃放过程中硝酸钾做氧化剂 | ||||
D、爆竹爆炸过程中发生反应为2KNO3+3C+S
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4molNaCl所含离子数 |
| B、标准状况下5.6L CO2所含原子数 |
| C、1L1 mol?L-1盐酸所含HCl分子数 |
| D、10g氖气所含原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准情况下,22.4LH2含有的分子数为1NA |
| B、常温常压下,1.06gNa2CO3(相对分子质量为106)含有的Na+离子数为0.02NA |
| C、常温常压下,6.02×1023个CO2分子占有的体积为22.4L |
| D、1L物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
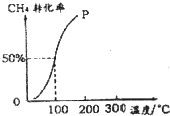 甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:
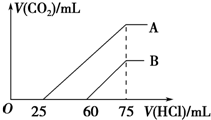 向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.
向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X是形成化合物种类最多的元素,它的一种气态氧化物能产生温室效应 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z和Y形成的一种化合物Z2Y2为淡黄色粉末,可作为呼吸面具里氧气的来源 |
| V | V的单质是淡黄色固体,是黑火药的一种主要成分 |
| W | W的单质是人们最早发现和使用的金属之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com