
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源:2014-2015浙江省高二4月月考化学试卷(解析版) 题型:选择题
下列有机物的命名中,正确的是
A.3—甲基—1—丁烯 B.2—乙基丁烷
C.2,2—二甲基—4—丁醇 D.2,3,3—三甲基丁烷
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二下学期4月阶段性测试化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是
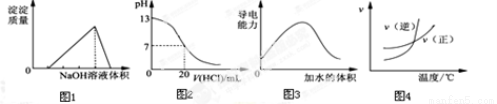
A.图1表示向某硫酸和硫酸铝混合溶液中加入NaOH溶液,沉淀质量与加入NaOH溶液体积的关系
B.图2表示25℃时,用0.1molL-1盐酸滴定20mL0.1molL-1NaOH溶液的pH随加入盐酸体积的变化
C.图3表示t℃时稀释冰醋酸过程中溶液导电性的变化
D.根据图4可判断某可逆反应的正反应是吸热反应
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省杭州市下学期高二4月月考化学试卷(解析版) 题型:选择题
有机物C4H8Cl2的同分异构体中只含一个“—CH3”的有
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省高二下学期第一次月考化学试卷(解析版) 题型:简答题
(探究题)汽油不仅是最重要的燃料,而且是重要的化工原料,它既可以裂解得到气态化工原料如乙烯等,还可以在催化剂催化下改变分子结构,由链烃变成芳香烃,如己烷变成苯,庚烷变成甲苯,这个变化叫异构化。请根据以汽油为原料的下列衍变关系,写出相应的化学方程式及反应类型。
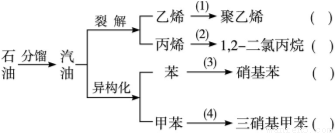
(1)________________________________________________________________。
(2)________________________________________________________________。
(3)________________________________________________________________。
(4)________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列试剂不能跟HCHO反应的是
①Ag(NH3)2OH ②新制Cu(OH)2 ③O2 ④KMnO4酸性溶液 ⑤CH3CH2OH
A.①②③ B.④⑤ C.④ D.⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷(解析版) 题型:简答题
(13分)(1)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g) 2C(g)+D(s) △H1<0反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
2C(g)+D(s) △H1<0反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。

①该反应的平衡常数表达式为K=___。升高温度,平衡常数将____(填“增大”“减小 ”或“不变”)。
”或“不变”)。
②能判断该反应是 否达到化学平衡状态的依据是________。
否达到化学平衡状态的依据是________。
A.容器中压强不 变
变
B.混合气体的密度不变
C.υ(A):υ(B):υ(C)=2:1:2
D.c(A)=c( C)
C)
(2)为研究不同条件对反应2NO(g)+Cl2(g) 2C1NO(g) △H2<0的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol C12,10 min时反应达到平衡。测得NO的转化率为
2C1NO(g) △H2<0的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol C12,10 min时反应达到平衡。测得NO的转化率为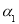 。其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率为
。其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率为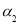 ,则
,则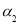 __________
__________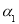 ,(填“大于”“小于”或“等于”)。
,(填“大于”“小于”或“等于”)。
(3)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义。为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2—离子。电池工作时负极反应式为_________________。用该燃料电池作电源,以石墨为电极电解足量的硫酸铜溶液,当电路中通过0.1 mol电子时,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入_____(填物质名称),其 质量约为_______g。
质量约为_______g。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.用石墨作电极电解饱和食盐水时,若阴极得到2NA个电子,则阳极产生22.4 L气体
B.2 L 0.05 mol/L乙酸溶液中H+数为0.1NA
C.等物质的量的Na2O和Na2O2中含有的阴离子总数不同
D.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市、石嘴山市高三四月联考理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。
(1)基态E原子的价电子排布图_______________。
(2)B、C、D三元素第一电离能由大到小的顺序为 (用元素符号表示)。
(3)BD32-中心原子杂化轨道的类型为________杂化;CA4+的空间构型为__________(用文字描述)。
(4)1mol BC-中含有π键的数目为______NA。
(5)D、E元素最简单氢化物的稳定性 _____> _____ (填化学式),理由是 。
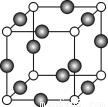
(6)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 _____ ,C原子的配位数是 _____。若相邻C原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为______g/cm3(用含a、NA的符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com