
科目:高中化学 来源:不详 题型:填空题
 符号:
符号: ;
;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
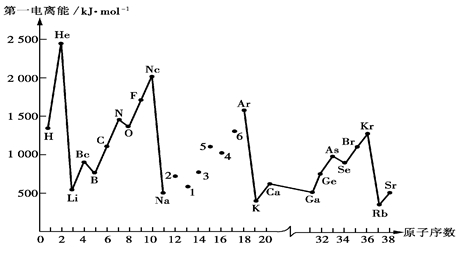
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | |
 当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是____________________(填离子键或共价键)。
当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是____________________(填离子键或共价键)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

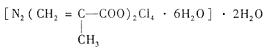 该化合物中存在的化学键类型有 。甲基丙烯酸分子中C原子的杂化方式有 。
该化合物中存在的化学键类型有 。甲基丙烯酸分子中C原子的杂化方式有 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 离子最外层有2个电子,该阳离子有6个电子层。由此推知下列说法中正确的是( )
离子最外层有2个电子,该阳离子有6个电子层。由此推知下列说法中正确的是( )| A.X元素位于元素周期表的第六周期第ⅣA族 | B.X元素的还原性比铝元素强 |
| C.X(OH)3和Al(OH)3一样是两性氢氧化物 | D.离子半径X3+ > X+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②⑤⑥⑧ | B.①③④⑤ | C.②④⑤⑦ | D.③⑤⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com