
| ag |
| 100g/mol |
| a |
| 100 |
| a |
| 100 |
| ||
| VL |
| a |
| 100V |
| a |
| 100 |
| ||
| VL |
| a |
| 50V |
| a |
| 100 |
| ||
| VL |
| a |
| 100V |
| a |
| 100 |
| ||
| VL |
| a |
| 50V |


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
| A、n1=n2 |
| B、n1>n2 |
| C、n1<n2 |
| D、C(A-)<C(B-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,NO2和N2O4的混合物46g中含有2NA个氧原子 |
| B、常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA |
| C、10mL98%的浓H2SO4用水稀释至l00mL,H2SO4的质量分数为9.8% |
| D、标准状况下,80g SO3中含3NA个氧原子,体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知原子序数依次增大的A、B、C、D、E五种元素中有2种为非金属元素,其原子序数均小于30.其中A、B、C、E的价电子层中均有2个未成对电子,A、B同族且可以形成原子个数比为1:1的化合物BA,属于原子晶体.回答下列问题:
已知原子序数依次增大的A、B、C、D、E五种元素中有2种为非金属元素,其原子序数均小于30.其中A、B、C、E的价电子层中均有2个未成对电子,A、B同族且可以形成原子个数比为1:1的化合物BA,属于原子晶体.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
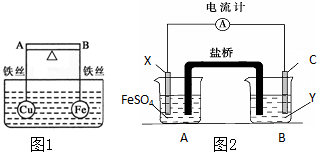 (1)如图1所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)当杠杆为绝缘体时,A端比B端
(1)如图1所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)当杠杆为绝缘体时,A端比B端查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
| B、醋酸溶液和大理石反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、NH4Al(SO4)2溶液中滴加少量的NaOH:NH4++OH-=NH3?H2O |
| D、向Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2↑+S↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com