
|
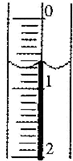
某同学按右图所示的装置进行电解实验.下列说法正确的是
| |
A. |
电解过程中,铜电极上有H2产生 |
B. |
电解初期,主反应方程式为:Cu+H2SO4 |
C. |
电解一定时间后,石墨电极上有铜析出 |
D. |
整个电解过程中,H+的浓度不断增大 |
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:阅读理解
 某化学兴趣小组使用酸碱中和滴定法测定市售白醋(主要成分为CH3COOH)的总酸量(g/100ml).
某化学兴趣小组使用酸碱中和滴定法测定市售白醋(主要成分为CH3COOH)的总酸量(g/100ml).| 实验数据(mL)/滴定次数 | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(8分)甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:①准确配制0.1mol·L-1的HA、HCl溶液各100mL;
②取纯度相同,质量、大小相等的锌粒放入两只试管中,同时加入0.1mol·L-1的HA、HCl溶液各100mL,按上图装好,观察现象。
乙:①用pH计测定物质的量浓度均为0.1mol·L-1的HA和HCl溶液的pH;
②再取0.1mol·L-1的HA和HCl溶液各2滴(1滴约为![]() )分别稀释至100mL,
)分别稀释至100mL,
再用pH计测其pH变化。
(1)乙方案中说明HA是弱电解质的理由是,测得0.1mol·L-1的HA溶液的pH 1(填“>”“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是 。
A.装HCl的试管中放出的氢气速率大
B.装HA溶液的试管中放出氢气的速率大
C.两个试管中产生气体速率一样大
(2)乙同学设计的实验第②步,能证明改变条件解质平衡发生移动。加水稀释,弱酸HA的电离程度 (填“增大、减小、不变”)
(3)甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:使HA的电离程度和c(H+)都减小,c(A)增大,可在0.1mol·L-1的HA溶液中,选择加入 试剂。
A.NaA固体(可完全溶于水) B.1mol·L-1NaOH溶液
C.1mol·L-1H2SO4 D.2mol·L-1HA
(4)pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如右图所示,则下列说法不正确的有
A.若a=4,则A是强酸,B是弱酸
B.若![]() ,则A、B都是弱酸
,则A、B都是弱酸
C.两种酸溶液的物质的量尝试一定相等
D.稀释后,A溶液的酸性比B溶液弱
查看答案和解析>>
科目:高中化学 来源:2010年北京市高三上学期起点考试化学试题 题型:实验题
(8分)甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:①准确配制0.1mol·L-1的HA、HC l溶液各100mL;
l溶液各100mL;
②取纯度相同,质量、大小相等的锌粒放入两只试管中,同时加入0.1mol·L-1的HA、HCl溶液各100mL,按上图装好,观察现象。
乙:①用pH计测定物质的量浓度均为0.1mol·L-1的HA和HCl溶液的pH;
②再取0.1mol·L-1的HA和HCl溶液各2滴(1滴约为 )分别稀释至100mL,
)分别稀释至100mL,
再用pH计测其pH变化。
(1)乙方案中说明HA是弱电解质的理由是,测得0.1mol·L-1的HA溶液的pH 1(填“>”“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是 。
A.装HCl的试管中放出的氢气速率大
B.装HA溶液的试管中放出氢气的速率大
C.两个试管中产生气体速率一样大
(2)乙同学设计的实验第②步,能证明改变条件解质平衡发生移动。加水稀释,弱酸HA的电离程度 (填“增大、减小、不变”)
(3)甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:使HA的电离程度和c(H+)都减小,c(A)增大,可在0.1mol·L-1的HA溶液中,选择加入 试剂。
A.NaA固体(可完全溶于水) B.1mol·L-1NaOH溶液
C.1mol ·L-1H2SO4 D.2mol·L-1HA
·L-1H2SO4 D.2mol·L-1HA
(4)pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL ,其pH与溶液体积V的关系如右图所示,则下列说法不正确的有
,其pH与溶液体积V的关系如右图所示,则下列说法不正确的有 
A.若a=4,则A是强酸,B是弱酸
B.若 ,则A、B都是弱酸
,则A、B都是弱酸
C.两种酸溶液的物质的量尝试一定相等
D.稀释后,A溶液的酸性比B溶液弱
查看答案和解析>>
科目:高中化学 来源:2010年北京市高三上学期起点考试化学试题 题型:实验题
(8分)甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:

甲:①准确配制0.1mol·L-1的HA、HCl溶液各100mL;
②取纯度相同,质量、大小相等的锌粒放入两只试管中,同时加入0.1mol·L-1的HA、HCl溶液各100mL,按上图装好,观察现象。
乙:①用pH计测定物质的量浓度均为0.1mol·L-1的HA和HCl溶液的pH;
②再取0.1mol·L-1的HA和HCl溶液各2滴(1滴约为 )分别稀释至100mL,
)分别稀释至100mL,
再用pH计测其pH变化。
(1)乙方案中说明HA是弱电解质的理由是,测得0.1mol·L-1的HA溶液的pH 1(填“>”“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是 。
A.装HCl的试管中放出的氢气速率大
B.装HA溶液的试管中放出氢气的速率大
C.两个试管中产生气体速率一样大
(2)乙同学设计的实验第②步,能证明改变条件解质平衡发生移动。加水稀释,弱酸HA的电离程度 (填“增大、减小、不变”)
(3)甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:使HA的电离程度和c(H+)都减小,c(A)增大,可在0.1mol·L-1的HA溶液中,选择加入 试剂。
A.NaA固体(可完全溶于水) B.1mol·L-1NaOH溶液
C.1mol·L-1H2SO4 D.2mol·L-1HA
(4)pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如右图所示,则下列说法不正确的有

A.若a=4,则A是强酸,B是弱酸
B.若 ,则A、B都是弱酸
,则A、B都是弱酸
C.两种酸溶液的物质的量尝试一定相等
D.稀释后,A溶液的酸性比B溶液弱
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
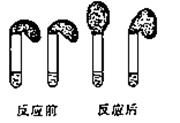
甲:①准确配制0.1mol·L-1的HA、HCl溶液各100mL;
②取纯度相同,质量、大小相等的锌粒放入两只试管中,同时加入0.1mol·L-1的HA、HCl溶液各100mL,按上图装好,观察现象。
乙:①用pH计测定物质的量浓度均为0.1mol·L-1的HA和HCl溶液的pH;
②再取0.1mol·L-1的HA和HCl溶液各2滴(1滴约为![]() )分别稀释至100mL,
)分别稀释至100mL,
再用pH计测其pH变化。
(1)乙方案中说明HA是弱电解质的理由是,测得0.1mol·L-1的HA溶液的pH 1(填“>”“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是 。
A.装HCl的试管中放出的氢气速率大
B.装HA溶液的试管中放出氢气的速率大
C.两个试管中产生气体速率一样大
(2)乙同学设计的实验第②步,能证明改变条件解质平衡发生移动。加水稀释,弱酸HA的电离程度 (填“增大、减小、不变”)
(3)甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:使HA的电离程度和c(H+)都减小,c(A)增大,可在0.1mol·L-1的HA溶液中,选择加入 试剂。
A.NaA固体(可完全溶于水) B.1mol·L-1NaOH溶液
C.1mol·L-1H2SO4 D.2mol·L-1HA
(4)pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如右图所示,则下列说法不正确的有
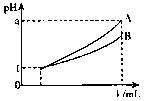
A.若a=4,则A是强酸,B是弱酸
B.若![]() ,则A、B都是弱酸
,则A、B都是弱酸
C.两种酸溶液的物质的量尝试一定相等
D.稀释后,A溶液的酸性比B溶液弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com