
【题目】铬渣是生产金属铬和铬盐过程中产生的工业废渣,其中含有Na2SO4及少量Cr2O72—、Fe3+。从铬渣中提取Na2SO4的工艺流程:

已知:常温时,Fe3+、Cr3+完全沉淀时c≤1×10-5mol·L-1,Ksp[Fe(OH)3]=4×10-38,Ksp[Cr(OH)3]=6×10-31。
(1)调pH约为3.6目的是_________。
(2)根据下图溶解度(S)—温度(T)曲线,判断操作B为蒸发浓缩、_________________。
(3)“酸化、还原”步骤反应的离子方程式为_______________________________。
(4)滤渣D为________________________(填化学式)。
(5)如图,某工厂采用电解法处理含铬废水,用铁板作阴阳极,槽中盛放含铬废水,A接电源的_______极;阳极区溶液中发生的氧化还原反应为__________________。若不考虑气体的溶解,当收集到6.72L(标准状况)的H2时,理论上有___molCr2O72—被还原。

【答案】使Fe3+完全生成Fe(OH)3沉淀 趁热过滤 3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O Cr(OH)3 正 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O 0.05
【解析】
分析流程图,铬渣用水浸取后加入稀NaOH溶液并调节pH为3.6并微热,可使Fe3+转化为Fe(OH)3沉淀,通过过滤除去。滤液进行蒸发浓缩、趁热过滤可以得到产品,过滤出的母液经酸酸化,与Na2SO3发生氧化还原反应,使Cr2O72-还原为Cr3+,通过加入NaOH调节溶液的pH使Cr3+转化为Cr(OH)3而除去,同时提取溶液中的Na2SO4得到产品。据此进行分析。
(1)根据题给信息,调节pH为3.6的目的是使Fe3+完全沉淀,答案为:使Fe3+完全沉淀;
(2)根据图中溶解度(S)—温度(T)曲线可知,达到一定温度再升温,Na2SO4溶解度降低,所以判断操作B为蒸发浓缩,趁热过滤。答案为:趁热过滤;
(3)根据流程图可知,母液中含有Cr2O72–,在酸C提供H+的条件下,可将SO32-氧化成SO42-,故离子反应方程式为:3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;答案为:3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;
(4)由上述分析可知,滤渣D为Cr(OH)3;答案为:Cr(OH)3;
(5)由B极上产生氢气可知B极为阴极,则A极为阳极,接电源的正极。阳极区铁失去电子生成Fe2+,在溶液中Fe2+被Cr2O72-氧化,发生的氧化还原反应为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。由得失电子守恒可知,当收集到6.72L(标准状况)的H2时,即H2的物质的量=![]() 时,产生0.3molFe2+,根据反应方程式,可知理论上有0.05mol Cr2O72-被还原。答案为:正;6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;0.05。
时,产生0.3molFe2+,根据反应方程式,可知理论上有0.05mol Cr2O72-被还原。答案为:正;6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;0.05。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下列各组有机化合物中,不论两者以什么比例混合,只要总物质的量一定,则完全燃烧时生成的水的质量和消耗氧气的质量不变的是
A.C3H8,C4H6B.CH4O,C3H4O5
C.C2H6,C4H6O2D.C3H6,C4H6O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,pH=2的某酸HnA(An—为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为5。下列判断正确的是
A.生成的正盐化学式为BmAn
B.该盐中存在着一定水解的离子,该离子水解方程式为Bm++mH2O![]() B(OH)m+mH+
B(OH)m+mH+
C.生成的盐为强酸弱碱盐
D.HnA为弱酸,其第一步电离方程式为HnA![]() Hn-1A-+H+
Hn-1A-+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室研究某些气体的性质可用如图所示装置,下列过程和结论均正确的是

项选 | X | Y | Z | 结论 |
A | Br2 | 苯 | NaOH 溶液 | 苯与溴发生取代反应 |
B | SO2 | 酸性KMnO4溶液 | NaOH 溶液 | 二氧化硫具有漂白性 |
C | HCl | Na2SiO3溶液 | NaCl 溶液 | Cl 的非金属性强于Si |
D | CH2= CH2 | Br2 的CCl4溶液 | AgNO3溶液 | 乙烯与Br2发生加成反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在日常生活中有着广泛的应用,下列有关化学用语和相关说法均正确的是
选项 | 化学反应方程式 | 相关说法 |
A |
| 氧气是氧化产物,氯酸钾既是氧化剂又是还原剂 |
B | Cl2+2Br-=2Cl-+Br2 Zn+Cu2+=Zn2++Cu | 均为单质被还原的置换反应 |
C | 4CuO | 该反应中每生成1molO2,则转移2NA个电子 |
D | 2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑ | 氧化性:Na2O2>Na2FeO4>FeSO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)COCl2的空间构型为______________,溴的基态原子价电子排布式为_____________。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____________(填字母)式发生。
A.CsICl2====CsCl+ICl B.CsICl2====CsI+Cl2
(3)根据表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是____。
元素 | 氟 | 氯 | 溴 | 碘 |
第一电离能/ (kJ·mol-1) | 1681 | 1251 | 1140 | 1008 |
(4)下列分子既不存在“s-p”σ键,也不存在“p-p”π键的是__________(填字母)。
A.HCl B.HF C.SO2 D.SCl2
(5)已知ClO2-为“V”形,中心氯原子周围有4对价层电子。ClO2-中心氯原子的杂化轨道类型为______________,写出一个与CN—互为等电子体的物质的分子式:______________。
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为__________。已知该氧化物的密度是ρg·cm-3,则晶胞内离得最近的两个钙离子的间距为_________cm(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。
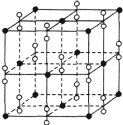
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A.在火柴头浸取的水溶液中滴入AgNO3溶液,稀硝酸溶液检验氯元素时离子反应:Ag++Cl-=AgCl↓
B.NaNO2溶液中滴加适量稀盐酸:2![]() +2H+=H2O+NO↑+NO2↑
+2H+=H2O+NO↑+NO2↑
C.向Cu(NO3)2溶液中加入过量氨水:Cu2++2NH3H2O= Cu(OH)2↓+2![]()
D.苯酚与三氯化铁溶液反应,得到溶液显紫色:6C6H5O-+Fe3+=[Fe(OC6H5)6]3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,中国科学院大连化物所CO2催化转化为CO的研究获得新成果。下图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化,下列说法正确的是
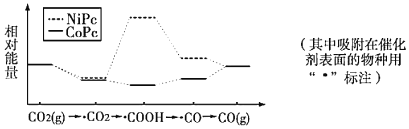
A.CO2(g)→CO(g)+l/2O2(g)过程中能量降低
B.CO2经氧化反应得到COOH
C.该条件下,催化剂NiPc比CoPc对CO2(g)→CO(g)转化效率更高
D.该研究成果将有利于缓解温室效应并解决能源转化问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;由A通过聚合反应生成高分子化合物F,F可用于工业合成塑料,现以A为主要原料合成G,以A为原料的合成路线如下图所示。

回答下列问题:
(1)D、G分子中的官能团名称分别__________、__________。
(2)在反应①~⑥中,属于加成反应的是______,属于取代反应的是_____。(填序号)
(3)写出与G分子式相同的所有羧酸类的同分异构体:_________________
(4)写出由C与新制氢氧化铜反应的化学方程式:_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com