


 ,
, ;1s22s22p63s23p63d54s1;
;1s22s22p63s23p63d54s1;| 1 |
| 8 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
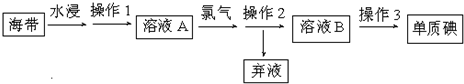
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(mg) | 255 | 385 | 459 |
| 气体体积(mL) | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 1mol?L-1的Na2CO3 溶液中含有CO32-的数目为NA |
| B、25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| C、一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数一定为0.1NA |
| D、1mol Fe与足量的稀HNO3反应,转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、田间焚烧秸秆污染环境,浪费资源 |
| B、泄露在海洋中的大量原油能被海洋生物迅速分解,不会导致生态灾难,不需要治理 |
| C、推广使用无磷洗涤剂,可有效减少水体的富营养化 |
| D、服用铬含量超标的药用胶囊会对从体健康造成危害 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com