
【题目】某废渣中含有Al 2O3和Cr2O3(三氧化二铬),再次回收利用工艺流程如下。

回答下列问题:
(1)滤液1中阴离子为CrO42-和AlO2-,X的电子式是_______。写出滤液1与过量气体X反应生成Al(OH) 3的离子方程式:_____________________。
(2)“熔烧”中反应之一是4Na2CO3+ 2Cr2O3+ 3O2 =4Na2CrO4+ 4X,该反应中被氧化的物质是______(填化学式);若该反应转移6mol电子,则生成_____mol Na2CrO4。
(3)“还原””中加入适量稀硫酸,调节pH=5,氧化产物为SO42-。写出离子方程式____________。
(4)已知该废料中含铬元素质量分数为a%,wt这样废料经上述流程提取mkgCr2O3。则该废料中铬元素回收率为_______(用代数式表示)。(已知回收率等于实际回收质量与理论质量之比)
【答案】![]() AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Cr2O3 2 8CrO42-+3S2O32-+34H+=6SO42-+8Cr3++17H2O
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Cr2O3 2 8CrO42-+3S2O32-+34H+=6SO42-+8Cr3++17H2O ![]()
【解析】
Al2O3与Na2CO3反应生成NaAlO2和X气体CO2,Cr2O3与Na2CO3反应生成Na2CrO4和X气体CO2,发生的反应为:4Na2CO3+2Cr2O3+3O2 =4Na2CrO4+4CO2,过滤得滤液1中阴离子为CrO42-和AlO2-,通入CO2,得到Al(OH)3,离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。滤液2中CrO42-,“还原””中加入适量稀硫酸,调节pH=5,发生反应:8CrO42-+3S2O32-+34H+=6SO42-+8Cr3++17H2O,加氨水反应后得到Cr(OH)3,加热分解得Cr2O3。
(1)滤液1中阴离子为CrO42-和AlO2-,X是CO2电子式是![]() 。滤液1主要成分为NaAlO2,与过量气体X反应生成Al(OH)3的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。(2)“熔烧”中反应之一是4Na2CO3+2Cr2O3+3O2 =4Na2CrO4+4X,铬元素由+3价升高为+6价,该反应中被氧化的物质是Cr2O3;由方程式每生成4molNa2CrO4,转移12mol电子,若该反应转移6mol电子,则生成2molNa2CrO4。(3)“还原””中加入适量稀硫酸,调节pH=5,氧化产物为SO42-。离子方程式8CrO42-+3S2O32-+34H+=6SO42-+8Cr3++17H2O。(4)mkgCr2O3中含铬mkg×
。滤液1主要成分为NaAlO2,与过量气体X反应生成Al(OH)3的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。(2)“熔烧”中反应之一是4Na2CO3+2Cr2O3+3O2 =4Na2CrO4+4X,铬元素由+3价升高为+6价,该反应中被氧化的物质是Cr2O3;由方程式每生成4molNa2CrO4,转移12mol电子,若该反应转移6mol电子,则生成2molNa2CrO4。(3)“还原””中加入适量稀硫酸,调节pH=5,氧化产物为SO42-。离子方程式8CrO42-+3S2O32-+34H+=6SO42-+8Cr3++17H2O。(4)mkgCr2O3中含铬mkg×![]() ,该废料中含铬元素质量分数为a%,wt这样废料中含铬1000wkg×a%,则该废料中铬元素回收率为
,该废料中含铬元素质量分数为a%,wt这样废料中含铬1000wkg×a%,则该废料中铬元素回收率为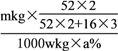 ×100%=
×100%=![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】以芳香烃A为原料合成有机物F和I的合成路线如下:

(1)A的分子式为__________,C中的官能团名称为________________。
(2)D分子中最多有______个原子共平面。
(3)E生成F的反应类型为___________,G的结构简式为__________。
(4)由H生成I的化学方程式为______________。
(5)符合下列条件的B的同分异构体有_______种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6:2:1:1的是________(写出其中一种的结构简式)。
①属于芳香化合物; ②能发生银镜反应。
(6)已知![]() ,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备
,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备![]() 的合成路线________________。
的合成路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应N2+3H2![]() 2NH3,用v(H2)和v(N2)分别表示其中的化合反应的速率,用v(NH3)表示其中分解反应的速率。下列能说明反应已达到平衡状态的是( )
2NH3,用v(H2)和v(N2)分别表示其中的化合反应的速率,用v(NH3)表示其中分解反应的速率。下列能说明反应已达到平衡状态的是( )
A.3v(N2)=v(H2)
B.v(H2)=v(NH3)
C.2v(H2)=3v(NH3)
D.v(N2)=3v(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值。乙醚(CH3CH2OCH2CH3)是一种麻醉剂。制备乙醚的方法是2CH3CH2OH![]() CH3CH2OCH2CH3+H2O.下列说法正确的是
CH3CH2OCH2CH3+H2O.下列说法正确的是
A. 18gH218O分子含中子数目为10NA
B. 每制备1molCH3CH218OCH2CH3必形成共价键数目为4NA
C. 10g46%酒精溶液中含H原子个数为1.2NA
D. 标准状况下,4.48L乙醇含分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像符合题意的是
A. 在盐酸和氯化铝的混合溶液中滴加烧碱溶液
B. 在碳酸钠与碳酸氢钠混合液中滴加盐酸
C. 在氢氧化钠溶液中通入氯气
D. 在氢氧化钡溶液中滴加碳酸氢钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 向FeCl3和KSCN混合溶液中,加入少量KCl固体 | 溶液颜色变浅 | FeCl3+3KSCN +3KCl平衡向逆反应方向移动 |
B | 向酸性高锰酸钾溶液中加入过量的FeI2固体 | 反应后溶液变黄 | 反应后溶液中存在大量Fe3+ |
C | 取3mL1 mol·L-1NaOH溶液,先加入3滴1 mol·L-1 MgCl2溶液,再加入3滴1 mol·L-1FeCl3溶液 | 出现红褐色沉淀 | Mg(OH)2的Ksp比Fe(OH)3的Ksp大 |
D | 常温下,向浓度、体积都相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 | 变红,前者红色更深 | 结合质子的能力:CO32->HCO3- |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的轨道表达式为________。
(2)2-巯基烟酸( )水溶性优于2–巯基烟酸氧钒配合物(
)水溶性优于2–巯基烟酸氧钒配合物( )的原因是___________________________________________________________________。
)的原因是___________________________________________________________________。
(3)各原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,下列物质中存在“离域π键”的是________。
A.SO2 B.SO42- C.H2S D.CS2
(4)尿素(H2NCONH2)尿素分子中,原子杂化轨道类型有________,σ键与π键数目之比为________。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如左下图)和六方氮化硼(如右下图),前者类似于金刚石,后者与石墨相似。

①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。左上图中原子坐标参数A为(0,0,0),D为(![]() ,
,![]() ,0),则E原子的坐标参数为________。X-射线衍射实验测得立方氮化硼晶胞边长为361.5pm,则立方氮化硼晶体中N与B的原子半径之和为________pm(
,0),则E原子的坐标参数为________。X-射线衍射实验测得立方氮化硼晶胞边长为361.5pm,则立方氮化硼晶体中N与B的原子半径之和为________pm(![]() =1.732)。
=1.732)。
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的计算表这式为________pm。(已知正六边形面积为![]() a2,a为边长)
a2,a为边长)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2 g铁粉与2.2 g硫粉均匀混合,在密闭容器中加热,冷却后加入足量盐酸,在标准状况下收集到气体的体积是( )
A. 11.2 L B. 5.6 L C. 4.48 L D. 2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
![]()
已知转化过程中的反应为2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com