
| A. | 肯定存在① | B. | 至少存在②和⑤ | C. | 无法确定是否有③ | D. | 至少存在①、④、⑤ |
分析 此固体投入水中得到澄清溶液,说明能相互反应生成沉淀的物质不能共存其中,该溶液可使酚酞呈红色,说明溶液显碱性,若向该溶液中加入稀硝酸至过量,有白色沉淀生成,说明沉淀是氯化银,那么溶液一定存在①NH4Cl和④AgNO3,据此解答即可.
解答 解:加入水中得澄清溶液,再滴加无色酚酞变红,说明溶液显碱性,故此固体中一定存在⑤NaOH,加过量硝酸有沉淀,沉淀只能是氯化银,故至少还存在①和④,即铵根与银离子反应生成氢氧化二铵合银存在于溶液中,不是沉淀,再加入硝酸到过量,银离子与氯离子生成难溶于稀硝酸的白色沉淀AgCl,故此溶液中一定存在的是①、④、⑤,不能确定是否存在②③,综上分析得出:B错误,故选B.
点评 本题考查学生物质之间的反应以及现象的有关知识,可以根据所学知识来回答,难度较大,本题中注意氢氧化二氨合银配合物溶于水.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①⑤ | C. | ①②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
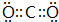 ,B与D形成的原子个数比为1:1的化合物的电子式是
,B与D形成的原子个数比为1:1的化合物的电子式是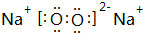 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H20
+H20| 相对分子质量 | 密度(g/cm3) | 沸点(℃) | 水中溶解性 | |
| 正丁酸 | 88 | 0.9587 | 163.5 | 溶 |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 丁酸异戊酯 | 158 | 0.886 | 179 | 不溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
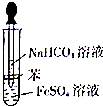 某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按右图所示操作将NaHCO3溶液滴加到FeS04溶液中(FeS04和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.
某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按右图所示操作将NaHCO3溶液滴加到FeS04溶液中(FeS04和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com