
【题目】现有常温下浓度均为![]() 的下列5种溶液:
的下列5种溶液:![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液
![]() 这5种溶液pH由大到小的顺序是________________,其中由水电离的
这5种溶液pH由大到小的顺序是________________,其中由水电离的![]() 浓度最小的是______。
浓度最小的是______。![]() 填序号
填序号![]()
![]() 中各离子浓度由大到小的顺序是________________________________________________________,
中各离子浓度由大到小的顺序是________________________________________________________,![]() 的水解平衡常数
的水解平衡常数![]() _________________。
_________________。![]() 已知碳酸的电离常数
已知碳酸的电离常数![]() ,
,![]()
![]() 向
向![]() 中通入少量氨气,此时
中通入少量氨气,此时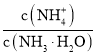 的值__________
的值__________![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
![]() 若将
若将![]() 和
和![]() 混合后溶液恰好呈中性,则混合前
混合后溶液恰好呈中性,则混合前![]() 的体积______
的体积______![]() 的体积
的体积![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() 。
。
![]() 将
将![]() 的溶液分别蒸干并灼烧,最终可得原溶质的是____________
的溶液分别蒸干并灼烧,最终可得原溶质的是____________![]() 填序号
填序号![]() 。
。
![]() 一定量的稀
一定量的稀![]() 溶液与足量的Zn反应,为减缓产生的
溶液与足量的Zn反应,为减缓产生的![]() 速率但又不影响
速率但又不影响![]() 的总量,可采取的措施是______
的总量,可采取的措施是______![]() 填字母
填字母![]() 。
。
A.加![]() 固体
固体![]() 加
加![]() 固体
固体![]() 加
加![]() 溶液
溶液![]() 加氨水
加氨水![]() 加
加![]() 溶液
溶液
![]() 常温下,向
常温下,向![]() 溶液中加入
溶液中加入![]() 溶液,可观察到的现象是_______________________________________,发生反应的离子方程式为______________________________,若将所得悬浊液的pH值调整为4,则溶液中
溶液,可观察到的现象是_______________________________________,发生反应的离子方程式为______________________________,若将所得悬浊液的pH值调整为4,则溶液中![]() 的溶液为_____
的溶液为_____![]()
![]() 已知常温下
已知常温下![]() 。
。
![]() 等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ____________ 性,溶液中
等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ____________ 性,溶液中![]() __________
__________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;![]() 的氢氧化钠与
的氢氧化钠与![]() 的醋酸等体积混合后溶液呈__________________性,溶液中
的醋酸等体积混合后溶液呈__________________性,溶液中![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;
![]() 常温下,用
常温下,用![]() 溶液滴定
溶液滴定![]() 某一元酸HA溶液所得滴定曲线如图.
某一元酸HA溶液所得滴定曲线如图.
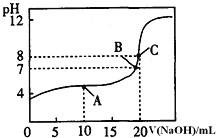
![]() A、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
A、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
![]() 点的离子浓度大小关系是 ________________________________ .
点的离子浓度大小关系是 ________________________________ .
【答案】![]()
![]()
![]()
![]() 减小 大于
减小 大于 ![]()
![]() 有红褐色沉淀生成,有气泡冒出
有红褐色沉淀生成,有气泡冒出 ![]()
![]() 碱
碱 ![]() 酸
酸 ![]()
![]()
![]()
【解析】
![]() 相同浓度的溶液中,
相同浓度的溶液中,![]() 溶液为酸性溶液,
溶液为酸性溶液,![]() 溶液中碳酸根离子部分水解,溶液显示弱碱性,
溶液中碳酸根离子部分水解,溶液显示弱碱性,![]() 溶液中铵离子部分水解,溶液显示弱酸性,
溶液中铵离子部分水解,溶液显示弱酸性,![]() 溶液为强碱溶液,
溶液为强碱溶液,![]() 溶液中铵离子部分水解,溶液显示弱酸性,但铵离子浓度大于
溶液中铵离子部分水解,溶液显示弱酸性,但铵离子浓度大于![]() 溶液,即
溶液,即![]() 溶液酸性大于
溶液酸性大于![]() 溶液,所以这5种溶液pH由大到小的顺序为:
溶液,所以这5种溶液pH由大到小的顺序为:![]() ;
;
![]() 为含有弱酸根或者弱碱根离子的盐溶液,促进了水的电离,而
为含有弱酸根或者弱碱根离子的盐溶液,促进了水的电离,而![]() 分别为酸和碱溶液,抑制了水的电离,其中
分别为酸和碱溶液,抑制了水的电离,其中![]() 电离的氢离子浓度大于
电离的氢离子浓度大于![]() 电离的氢氧根离子,所以
电离的氢氧根离子,所以![]() 中水的电离程度最小;
中水的电离程度最小;
![]() 碳酸氢钠溶液中,碳酸氢根离子水解使溶液呈碱性,说明碳酸氢根的水解程度大于电离程度,同时水存在电离平衡,所以碳酸氢钠溶液中离子浓度大小关系为:
碳酸氢钠溶液中,碳酸氢根离子水解使溶液呈碱性,说明碳酸氢根的水解程度大于电离程度,同时水存在电离平衡,所以碳酸氢钠溶液中离子浓度大小关系为:![]() ;碳酸氢钠溶液中的水解平衡常数为:
;碳酸氢钠溶液中的水解平衡常数为:![]() ;
;
故答案为![]() ,
, ![]() ;
;
![]() 一水合氨的电离平衡常数
一水合氨的电离平衡常数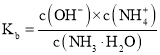 ,所以
,所以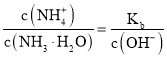 ,通入氨气后,溶液中氢氧根离子浓度增大,该比值减小;
,通入氨气后,溶液中氢氧根离子浓度增大,该比值减小;
![]() 若氯化铵与氢氧化钠溶液等浓度等体积混合,二者恰好反应生成氯化钠和氨水,溶液显示碱性,若要使溶液显示中性,则氯化铵的体积应该大些或者氢氧化钠溶液体积小些,即氯化铵溶液体积大于氢氧化钠溶液体积,
若氯化铵与氢氧化钠溶液等浓度等体积混合,二者恰好反应生成氯化钠和氨水,溶液显示碱性,若要使溶液显示中性,则氯化铵的体积应该大些或者氢氧化钠溶液体积小些,即氯化铵溶液体积大于氢氧化钠溶液体积,
![]() 和
和![]() 对热不稳定,受热易分解,NaOH受热不分解,所以灼烧可得原溶质的是NaOH溶液;
对热不稳定,受热易分解,NaOH受热不分解,所以灼烧可得原溶质的是NaOH溶液;
![]() 加醋酸钠固体,生成醋酸为弱电解质,溶液氢离子浓度降低,反应速率减小,但生成氢气的总量不变,故选A;
加醋酸钠固体,生成醋酸为弱电解质,溶液氢离子浓度降低,反应速率减小,但生成氢气的总量不变,故选A;
B.加![]() 固体,氯化铵水解呈酸性,生成氢气的总量增大,故不选B;
固体,氯化铵水解呈酸性,生成氢气的总量增大,故不选B;
C.加![]() 溶液,氢离子总量不变,但生成的硝酸有强氧化性,和Zn反应生成NO,使
溶液,氢离子总量不变,但生成的硝酸有强氧化性,和Zn反应生成NO,使![]() 的总量减小,故不选C;
的总量减小,故不选C;
D.加氨水,消耗酸,生成氢气总量减小,故不选D;
E.加![]() 溶液,氢离子总量不变,溶液总体积增大,氢离子浓度降低,反应速率减小,故选E;
溶液,氢离子总量不变,溶液总体积增大,氢离子浓度降低,反应速率减小,故选E;
故选AE;
![]() 是强酸弱碱盐,
是强酸弱碱盐,![]() 是强碱弱酸盐,
是强碱弱酸盐,![]() 和
和![]() 相互促进水解生成氢氧化铁沉淀、二氧化碳气体和氯化钠,所以所以现象为:有红褐色沉淀生成,有气泡冒出,反应的离子方程式为
相互促进水解生成氢氧化铁沉淀、二氧化碳气体和氯化钠,所以所以现象为:有红褐色沉淀生成,有气泡冒出,反应的离子方程式为![]() ;
;![]() 的溶液中
的溶液中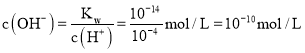 ,
,![]() ,所以溶液中
,所以溶液中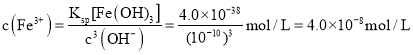 ,
,
故答案为有红褐色沉淀生成,有气泡冒出,![]() ,
,![]() ;
;
![]() 等体积、等浓度的氢氧化钠与醋酸混合,恰好反应生成醋酸钠溶液,溶液中的醋酸根离子水解溶液显碱性,钠离子浓度大于醋酸根离子,
等体积、等浓度的氢氧化钠与醋酸混合,恰好反应生成醋酸钠溶液,溶液中的醋酸根离子水解溶液显碱性,钠离子浓度大于醋酸根离子,![]() ,
,![]() 的氢氧化钠与
的氢氧化钠与![]() 的醋酸溶液中氢氧根离子浓度和氢离子浓度相同,等体积混合后醋酸又电离出氢离子,溶液显酸性,醋酸根离子浓度大于钠离子浓度,
的醋酸溶液中氢氧根离子浓度和氢离子浓度相同,等体积混合后醋酸又电离出氢离子,溶液显酸性,醋酸根离子浓度大于钠离子浓度,![]() ,
,
故答案为:碱,![]() ,酸,
,酸,![]() ;
;
![]() 0.1000mol/L的HA的pH>1,所以HA为弱酸,C点恰好反应生成盐,离子浓度最大,导电能力最强;A点时,溶液中的溶质为等浓度的NaA和HA,溶液呈酸性,所以HA的电离程度大于
0.1000mol/L的HA的pH>1,所以HA为弱酸,C点恰好反应生成盐,离子浓度最大,导电能力最强;A点时,溶液中的溶质为等浓度的NaA和HA,溶液呈酸性,所以HA的电离程度大于![]() 的水解程度,所以溶液中离子浓度大小的关系为
的水解程度,所以溶液中离子浓度大小的关系为![]() ,
,
故答案为:![]() ,
,![]() 。
。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量。常温下,将相同体积的盐酸和氨水分别加水稀释,溶液的电导率随加入水的体积V(H2O)变化的曲线如图所示,下列说法正确的是

A. 曲线I表示盐酸加水稀释过程中溶液电导率的变化
B. a、b、c三点溶液的pH:a>b>c
C. 将a、b两点溶液混合,所得溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)
D. 氨水稀释过程中,c(NH4+)/ c(NH3·H2O)不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中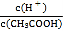 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 用牺牲阳极的阴极保护法保护船舶时,将船舶与石墨相连
B. 往含硫酸的淀粉水解液中,先加氢氧化钠溶液,再加碘水,检验淀粉是否水解完全
C. 反应3Si(s)+2N2(g)=Si3N4(s)能自发进行,则该反应的△H<0
D. 已知BaSO4的Ksp= (Ba2+ )·c(SO42-),所以BaSO4在硫酸钠溶液中溶解达到饱和时有c(Ba2+)=c(SO42-)=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度(t ℃)时,测得0.01 mol·L-1的NaOH溶液的pH=11,则该温度下水的Kw=______。在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,若所得混合液为中性,且a+b=12,则Va∶Vb=________。
(2)25 ℃时,0.1 mol·L-1的HA溶液中![]() =1010。请回答下列问题:
=1010。请回答下列问题:
①HA是________(填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是__________(填字母)。
a.c(HA) b.![]() c.c(H+)与c(OH-)的乘积 d.c(OH-)
c.c(H+)与c(OH-)的乘积 d.c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:
①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③ 0.1mol/L NH4HSO4
④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3H2O
请根据要求填写下列空白:
(1)溶液①呈_________性(填“酸”、“碱”或“中”),其原因是_____________(用离子方程式表示)。
(2)在上述五种溶液中,pH最小的是_____;c(NH4+)最小的是____(填序号)。
(3)在溶液④中,_____________离子的浓度为0.1mol/L;NH3H2O和________离子的物质的量浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7,则CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_____________c(NH4+)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:![]()
已知转化过程中的反应为2CrO42﹣(aq)+2H+(aq)![]() Cr2O72﹣(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6 g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是( )
Cr2O72﹣(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6 g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是( )
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要917.4 g
C. 常温下转化反应的平衡常数K=l×1014.则转化后所得溶液的pH=6
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.00 g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000 mL溶液。除了烧杯外,还需要的玻璃仪器有_____________ 、____________、和_____________。
(2)滴定:
①盛装0.1000 mol·L-1盐酸标准液应该使用_______________式滴定管。
②滴定时眼睛应________.
③有关数据记录如下:
测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.50 | 20.50 |
2 | 20.00 | 1.20 | 21.20 |
(3)计算纯度:烧碱样品的纯度是_______。
(4)误差分析(填“偏高”,“偏低”,或“无影响”)
a. 酸式滴定管用蒸馏水洗后未用标准液润洗,就直接装入标准液,造成测定结果____________。
b、锥形瓶水洗后,又用待测液润洗,,测定结果____________。
c、用碱式滴定管取待测液时,滴定管尖嘴处有气泡未排出就取液入锥形瓶,造成测定结果____________。
d、滴定前,锥形瓶用水洗涤后,锥形瓶中残留水未干燥,造成最终结果___。
e、酸式滴定管,滴定前仰视读数,滴定后平视读数,造成测定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com