
| A、若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 |
| B、2NO(g)+2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 |
| C、加热0.1mol?L-1 Na2CO3溶液,CO32-的水解程度和溶液的pH均增大 |
| D、对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |


科目:高中化学 来源: 题型:
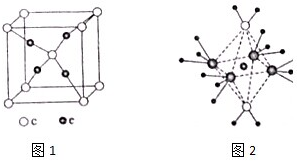 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有一个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有一个电子,但次外层有18个电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三个美国科学家因给复杂化学体系设计了多尺度模型而共享了2013年诺贝尔化学奖 |
| B、已知PM2.5是指大气中直径≤2.5×10-6m的颗粒物,则受PM2.5污染的大气不一定能产生丁达尔现象 |
| C、借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 |
| D、并不是所有金属元素都可以用焰色反应来确定其存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、① | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽油抗爆:甲基叔丁基醚代替四乙基铅 |
| B、处理废弃物:对废弃塑料露天焚烧 |
| C、工业制胆矾:使用稀硫酸、双氧水溶解铜 |
| D、火力发电:在燃煤中加入适量生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 碱式碳酸铝镁[MgaAlb(OH)c(CO3)d?xH2O]常用作塑料阻燃剂.
碱式碳酸铝镁[MgaAlb(OH)c(CO3)d?xH2O]常用作塑料阻燃剂.| 固体样品的剩余质量 |
| 固体样品的起始质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com