
科学家预言超级原子的发现将会重建周期表,2005年1月美国科学家在《Science》上发表论文,宣布发现了A1的超原子结构A113和A114,并在质谱仪检测到稳定的A113I一等,Al13、Al14的性质很像现行周期表中的某主族元素,己知这类超原子当具有40个价电子时最稳定(例Al原子具有3个价电子)。下列说法不正确的是
A. Al14有42个价电子,且与IIA族元素性质相似
B. Al13有39个价电子,且与卤素性质类似
C. Al13在气相中与HI反应可生成H Al13I,且化学
方程式为 AI13+HI=H AI13I
D. Al13原子中A1原子间是通过离子键结合的
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g) ΔH>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是 ( )。

| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
选用下列试剂和电极:稀 H2 SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计Ⓖ的指针均明显偏转,则其可能的组合共有 ( )。
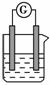
A.6种 B.5种
C.4种 D.3种
查看答案和解析>>
科目:高中化学 来源: 题型:
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是 ( )。

A.由TiO2制得1 mol金属Ti,理论上外电路通过2 mol电子
B.阳极的电极反应式为C+2O2--4e-===CO2↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组对电化学问题进行了实验探究。
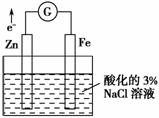
Ⅰ.利用如图所示装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。
(1)写出负极的电极反应________
________________________________________________________________。
(2)某学生认为,铁电极可能参与反应,并对产物作出假设。
假设 1 :铁参与反应,被氧化生成Fe2+;
假设 2 :铁参与反应,被氧化生成Fe3+;
假设 3 :________________________________________________________。
(3)为了探究假设1 、2,他采取如下操作:
①取0.01 mol·L-1 FeCl3溶液 2 mL于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴 K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴 KSCN 溶液,未见溶液变红。
据②、③、④现象得出的结论是__________________ _____________________________________。
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施:_________________________________________________________________。
Ⅱ.利用如图所示装置做电解 50 mL 0.5 mol·L-1的 CuCl2 溶液实验。

实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2 的氧化性强于IO );
);
B.电解一段时间以后,阴极表面除吸附有铜外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录 A 中试纸颜色的变化,用离子方程式解释:①________________②______________。
(2)分析实验记录 B 中浅蓝色固体可能是_____________________________
(写化学式),试分析生成该物质的原因:________________________________
________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化—还原法消除氮氧化物的转化如下: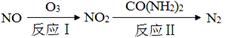
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)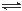 SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1,写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1,写出NO和O2反应生成NO2的热化学方程式 。
某化学兴趣小组构想将NO转化为HNO3,装置如下图一,电极为多孔惰性材料。则负极的电极反应式是 。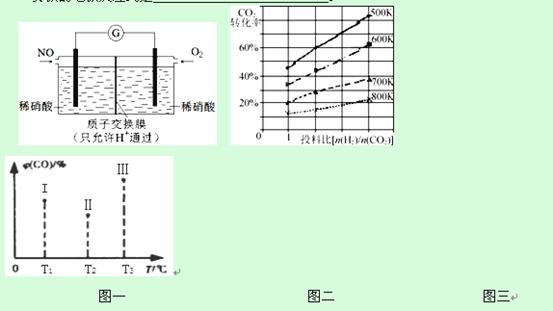
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如右图二所示。该反应的ΔH________(填“>”、“<”或“=”)0。
(5)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图三所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图三所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.1.2 g金刚石中含有的碳碳单键数为0.4NA
B.4.4 g二氧化碳中含有的共用电子对数为0.4NA
C.常温时11.2 L乙烯在氧气中完全燃烧转移的电子数为6.0NA
D.常温下0.1 mol·L-1硝酸铵溶液中,NH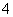 和H+总数一定大于0.1NA
和H+总数一定大于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aA(g)+bB(g)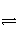
 cC(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系式中能说明反应已达到平衡状态的是( )
cC(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系式中能说明反应已达到平衡状态的是( )
A.av正(A)=bv正(B) B.bv正(A)=av逆(B)
C.av正(C)=cv正(A) D.av正(A)=bv逆(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol N2所含有的原子数为NA
B.标准状况下,16 g NH3中含有的分子数为NA
C.标准状况下,22.4 L氯化氢所含的原子数为NA
D.500 mL 1.0 mol·L-1硫酸钠溶液中所含的钠离子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com