
下列根据反应原理设计的应用,不正确的是
A.CO +H2O
+H2O HCO
HCO +OH- 用热的纯碱溶液清洗油污
+OH- 用热的纯碱溶液清洗油污
B.Al3++3H2O Al(OH)3(胶体)+3H+ 明矾净水
Al(OH)3(胶体)+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量)  TiO2·xH2O↓+4HCl 制备TiO2纳米粉
TiO2·xH2O↓+4HCl 制备TiO2纳米粉
D.SnCl2+H2O Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
科目:高中化学 来源: 题型:
工业上用铝土矿 (主要成分为Al2O3 、Fe2O3 、SiO2 )提取氧化铝做冶炼铝的原料,提取的操作过程如下:

写出步骤①、②、③中所发生反应的化学方程式:
①反应属于 (填反应类型), ② (填“是”“否”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组在实验室用重晶石(主要成分为BaSO4)对工业过程进行模拟实验 ,其焙烧过程的主要反应为:BaSO4(s)+4C(s)
,其焙烧过程的主要反应为:BaSO4(s)+4C(s) 4CO(g)+BaS(s)
4CO(g)+BaS(s)
(1)高温焙烧所产生的气体必须处理,其装置为________。

(2)重晶石高温焙烧产生的固体在用盐酸溶解时所产生的气体必须用CuSO4溶液吸收,吸收反应的化学方程式为_________________________________
________________________________________________________________________。
(3)在实验室进行过滤操作时所使用的玻璃仪器除了烧杯外,还有________、________。
(4)无论在工业上还是在实验室里,从滤液中获得目标产物BaCl2,采用的方法一般都是加热蒸发、____________________、洗涤、干 燥,而不是直接将溶液蒸干,其理由是________________________________________________________________________。
燥,而不是直接将溶液蒸干,其理由是________________________________________________________________________。
(5)在实验室里,BaCl2常用于检验溶液中是否存在SO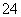 ,为了避免Ag+、CO
,为了避免Ag+、CO 、SO
、SO 等阴、阳离子的干扰,可先向溶液中加入
等阴、阳离子的干扰,可先向溶液中加入 ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y中含有相同的元素,Z、W中也含有相同的元素,根据反应X+H2O  Y+H2 ;Z+H2O
Y+H2 ;Z+H2O  W+O2 (方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为………… ( )
W+O2 (方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为………… ( )
A、X>Y、 Z>W B、X<Y、 Z<W C、X>Y、 Z<W D、X<Y、Z>W
查看答案和解析>>
科目:高中化学 来源: 题型:
下列水解 的离子方程式正确的是
的离子方程式正确的是
A.HCO +H2O
+H2O CO2↑+OH-
CO2↑+OH-
B.S2-+2H2O H2S+2OH-
H2S+2OH-
C.Fe3++3H2O Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D.CO +H2O
+H2O HCO
HCO +OH-
+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度、相同浓度下的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别为

A.NH4Cl (NH4)2SO4 CH3COONa
B.(NH4)2SO4 NH4Cl CH3COONa
C.(NH4)2SO4 NH4Cl NaOH
D.CH3COOH NH4Cl (NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
| 实验 编号 | HA的物质的量 浓度(mol·L-1) | NaOH的物质的量 浓度(mol·L-1) | 混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 |
| pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?
________________________________________________________________________。
(2)乙组混合溶液中c(A-)和c(Na+)的大小关系是________。
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是________________________________________________________________________。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=________ mol·L-1。
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B===H++HB- HB-H++B2-。
(5)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是_____ ___。
___。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c (H+)+c(HB-)
(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
苯甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。
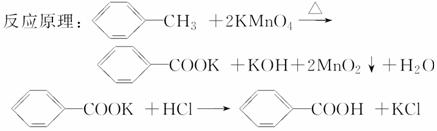
实验方法:一定量的甲苯和KMnO4溶液在100 ℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。

已知:苯甲酸相对分 子质量122,熔点122.4 ℃,在25 ℃和95 ℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
子质量122,熔点122.4 ℃,在25 ℃和95 ℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为________,操作Ⅱ为________。
(2)无色液体A是____________,定性检验A的试剂是________,现象是________________________________________________________________________。
(3)测定白色固体B的熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解,________ | 得到白色晶体和无 | |
| ② |
| 生成白色沉淀 | 滤液含Cl |
| ③ | 干燥白色晶体,________ | 白色晶体是苯甲酸 |
(4)纯度测定:称取1.220 g产品,配成100 mL甲醇溶液,移取25.00 mL溶液,滴定,消耗KOH的物质的量为2.40×10-3 mol。产品中苯甲酸质量分数的计算表达式为________,计算结果为________(保留二位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com