
【题目】酸性KMnO4、H2O2在生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除,Fe(NO3)3也是重要的氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式____________________,氧化产物与还原产物的物质的量之比为_______。
(2)取300 mL 0.2 mol·L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量是_____ mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是_________________(用文字表达),又变为棕黄色的离子方程式是_____________________。
(4)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.474 g KMnO4样品溶解酸化后,用0.100 mol·L-1标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在___(填“酸式”或“碱式”)滴定管中。配平上述反应的离子方程式:___MnO4-+___S2O32-+____H+=____Mn2++_____SO42-+____H2O,实验中,滴定至终点时消耗Na2S2O3溶液12.00 mL,则该样品中KMnO4的物质的量是_____。
【答案】Cu+2H++H2O2![]() Cu2++2H2O1∶20.16Fe3+被还原成Fe2+3Fe2++4H++NO3-
Cu2++2H2O1∶20.16Fe3+被还原成Fe2+3Fe2++4H++NO3-![]() 3Fe3++NO↑+2H2O碱式8MnO4-+5S2O32-+14H+
3Fe3++NO↑+2H2O碱式8MnO4-+5S2O32-+14H+![]() 8Mn2++10SO42-+7H2O1.92×10-3 mol
8Mn2++10SO42-+7H2O1.92×10-3 mol
【解析】
(1)铜片的稀盐酸中加入H2O2后,铜片溶解,发生氧化还原反应生成氯化铜、水;(2)0.06molI-→0.02molI2+0.02IO3-转移0.16mol电子,由电子守恒计算参加反应的n(KMnO4);(3)先由棕黄色变为浅绿色,过一会又变为棕黄色,则Fe3+先被还原生成Fe2+,Fe2+又被氧化生成Fe3+;(4)KMnO4样品溶解酸化后,与Na2S2O3溶液反应,反应的离子方程式为8MnO4-+5S2O32-+14H+=8Mn2++10SO42-+7H2O,根据方程式中MnO4-、S2O32-之间的关系式计算;
(1)盐酸不能与金属铜反应,加入H2O2后,发生氧化还原反应,铜片溶解生成氯化铜、水,该反应的离子方程式为:Cu+2H++H2O2=Cu2++2H2O,氧化产物氯化铜与还原产物水的物质的量之比为1:2;(2)n(KI)=0.06mol,与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则n(I2)=n(KIO3)=0.02mol,共失去电子的物质的量为2×0.02mol+0.02mol×[5-(-1)]=0.16mol;(3)先由棕黄色变为浅绿色,说明Fe3+先被还原为Fe2+,变为浅绿色的离子方程式是2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,后变为棕黄色的原因是反应生成的H+与NO3-组成的硝酸将Fe2+氧化为Fe3+,反应的离子方程式是3Fe2++4H++NO3-=3Fe3++
NO↑+2H2O;(4)Na2S2O3在溶液中水解,使溶液显碱性,所以标准Na2S2O3溶液应盛装在碱式滴定管中;酸性条件下MnO4-将S2O32-氧化为SO42-,本身被还原为Mn2+,反应的离子方程式为8MnO4-+5S2O32-+14H+=8Mn2++10SO42-+7H2O;实验中,消耗n(S2O32-)=0.100molL-1×0.012L
=0.0012mol,由得失电子数目守恒得:n(MnO4-)×5=0.0012mol×4×2,得n(MnO4-)=1.92×10-3 mol,则该样品中KMnO4的物质的量是1.92×10-3mol。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分生成物和反应条件已略去)。A为由两种元素组成的固体,含非金属质量分数为39.13%;D、E、L均为无色气体,E和L难溶于水;F为常见金属;G、I、J焰色反应显黄色;M为有颜色的固体。
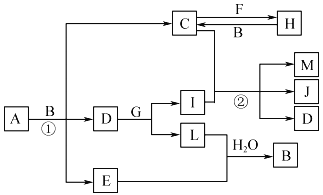
请回答下列问题:
(1)E的化学式为___________________。
(2)G的电子式为___________________。
(3)写出反应①的化学方程式:_______________________________。
(4)写出反应②的离子方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1NaHCO3与0.1 mol·L-1NaOH等体积混合所得的溶液中,粒子的物质的量浓度关系不正确的是( )
A.c(Na+)>c(CO32-)>c(HCO3-)>c(H2CO3)
B.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
C.c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
D.c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是;2Cu2O+ Cu2S![]() 6Cu+SO2。回答下列问题。
6Cu+SO2。回答下列问题。
(1)Cu+的价电子轨道表示式为__________________;Cu2O与Cu2S比较,熔点较高的是_______,原因为_____________________________________。
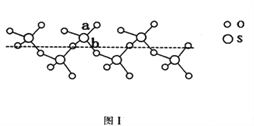
(2)SO2与SO3的键角相比,键角更大的是____________。将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图1所示。此固态SO3中S原子的杂化轨道类型是_______;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为_________(填图中字母)。
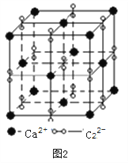
(3)离子化合物CaC2的一种晶体结构如下图2所示。写出该物质的电子式_____。从钙离子看,属于____________堆积;一个晶胞含有的π键平均有______个。

(4)奥氏体是碳溶解在γ—Fe中形成的一种间隙固溶体,无磁性,其晶胞如上图3所示,则该物质的化学式为________,若晶体密度为dg/cm3,则晶胞中最近的两个碳原子的距离为____________________ pm。(阿伏加德罗常数的值用NA表示,写出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的氧化物极为复杂。为测定一种铁的氧化物样本X的化学式,实验过程如下:

根据实验结果,该氧化物X的化学式为
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[ KAl(SO4)2·12H2O ]在造纸、净水等方面应用广泛。以处理过的废旧易拉罐碎屑为原料(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。

回答下列问题:
(1)原料溶解过程中反应的离子方程式是_________________________。
(2)Al(OH)3 与稀硫酸反应的离子方程式是__________________________。
(3)溶液A中通入过量CO2,反应的离子方程式是_________________。
(4)为证明固体B中含有铁,某同学做如下实验:取少量固体B,加入稀硫酸使其溶解,观察到有无色气体生成。向溶液中加入___________,溶液立即变红,证明固体B中含有铁。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用如图的实验装置测定Na2O2试样的纯度。
回答下列问题:

(1)装置A中盛放稀盐酸的仪器名称为__________________。
(2)装置B的作用是______________________________________。
(3)装置C的作用是____________________________________________。
(4)装置D中发生反应的化学方程式是_____________、_______________。
(5)装置E中碱石灰的作用是______________________________________。
(6)若开始时称得样品的质量为4.52 g,反应结束后称得固体的质量为6.36g,则Na2O2试样的纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示.
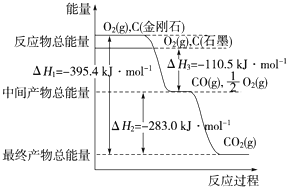
(1)等量金刚石和石墨完全燃烧___(填“金刚石”和“石墨”)放出热量更多,写出石墨完全燃烧的热化学方程式___。
(2)在通常状况下,金刚石和石墨___(填“金刚石”和“石墨”)更稳定,写出石墨转化为金刚石的热化学方程式:_______________。
(3)12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu、Ni、V为制造合金及合成催化剂的重要元素。请回答:
(1)基态铜原子的电子排布式是_________________。基态铜原子价电子层排布依据的原理,可用于解释下列事实的是___________。
A.Fe2+易被氧化为Fe3+ B.铜丝灼烧时焰色呈绿色
C.N的第一电离能大于O的第一电离能 D.NaCl的熔点比KCl的高
(2)[Cu(NH3)4]SO4是一种重要的配合物。与SO42-互为等电子体的分子的化学式为__________(任写一种)。NH3与CH4的VSPER构型相同,其中NH3的键角较小,原因是____________。Ni(CO)4中σ键和π键的数目之比为_________。
(3)钒的某种配合物有增强胰岛素和降糖作用,其分子结构如图所示。
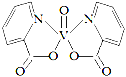
① 基态V元素的价层电子轨道表示式______________________,分子中非金属元素电负性由大到小的顺序为________。
② 该物质的晶体中除配位键外,所含微粒间作用力的类型还有___________(填序号)。
a.金属键 b.极性键 c.非极性键 d.范德华力 e.氢键
③ 1mol分子中含有配位键的数目是______,分子中采取sp2杂化的原子有_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com