
运用化学反应原理知识回答下列有关碳和碳的化合物的问题:
(1)汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
①请结合上表数据,写出NO与CO反应的化学方程式 .
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,根据表中数据计算K1= 。根据表中数据判断,温度T1和T2的关系是(填序号)__________。
A.T1>T2B.T1<T2 C.T1=T2 D.无法比较
(2)反应生成的气体E经常用氢氧化钠来吸收,现有0.4molE,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: .
(3)已知CH4、H2和CO的燃烧热分别为890.3kJ/mol,285.8 kJ/mol和283.0 kJ/mol,工业上利用天然气(主要成分是CH4)与CO2进行高温重整制备CO和H2,写出该反应的热化学方程式: .
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO为负极燃气,空气与CO2 的混合气为正极助燃气,制得在 650 ℃下工作的燃料电池,写出其负极和正极电极反应方程式:负极: ;正极: .
【知识点】化学平衡移动、计算、热化学方程式书写、盖斯定律、电极反应式的书写
 【答案解析】 (1)①2CO+2NO N2+2CO2(2分)
【答案解析】 (1)①2CO+2NO N2+2CO2(2分)
②3200 L/mol(或3200)(2分) A(2分)
⑵C(Na+)>C(HCO3-)>C(CO32-)>C(OH -)>C(H+)(2分)
(3) CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.3 kJ•mol -1(2分)
⑷2CO+2CO32--4e-=4CO2(2分)O2+2CO2+4e-=2CO32-(2分)
解析:(1)①NO和CO在一定条件下转化为两种无毒气体E和F,是氮气和二氧化碳,反
 应的方程式为2CO+2NO N2+2CO2;通过平衡时各物质的物质的
应的方程式为2CO+2NO N2+2CO2;通过平衡时各物质的物质的
 量也验证这一反应;②利用“三段式”进行计算:2CO + 2NO N2 + 2CO2
量也验证这一反应;②利用“三段式”进行计算:2CO + 2NO N2 + 2CO2
始态浓度(mol/L)0.05 0.05 0 0
变化量(mol/L) 0.04 0.04 0.02 0.04
平衡浓度(mol/L) 0.01 0.01 0.02 0.04
则K=C(N2)·C2(CO2)/ C2(CO)·C2(NO)=3200 L/mol;
该反应放热,从表中看出,从T1到T2,平衡正向移动,降低温度,故A.T1>T2;
(2)气体E是CO2,0.4mol CO2,用200mL 3mol/L NaOH溶液(物质的量是0.6mol)将其完全吸收,产物生成0.2molNa2CO3和0.2molNaHCO3,CO32-和HCO3-要水解使溶液呈碱性,前者的水解程度远大于后者,所以离子浓度大小:
C(Na+)>C(HCO3-)>C(CO32-)>C(OH -)>C(H+)
(3) 根据CH4、H2、和CO的燃烧热可知,各物质燃烧的热化学方程式:
①O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ•mol -1;
②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ•mol-1;
③2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1,
利用盖斯定律将②-①-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3 kJ•mol -1;
(4)在燃料池中,正极上是CO2发生失去电子的氧化反应,电极反应为:O2+2CO2+4e-=2CO32-,负极上是CO发生失电子的氧化反应,反应式:2CO+2CO32--4e-=4CO2,在转移电子一样多的情况下,两极反应相加得到总反应:2CO+O2=2CO2;
【思路点拨】本题考查比较综合,可逆反应平衡常数的简单计算方法,盖斯定律的应用。注意书写热化学方程式的要领;电极反应式的书写要看电解质中的离子存在形式。难度中等。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
已知电离平衡常数:H2CO3>HClO>HCO ,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是 ( )
,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是 ( )
A.向FeI2溶液中滴加少量氯水,反应的离子方程式为2Fe2++Cl2=3Fe3++2Cl-
B.向溴水中加入足量氯化亚铁溶液能使溴水变成无色
C.向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O=2HClO+CO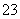
D.能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温常压下,22.4 L NH3中含有3NA个N—H键
B.1 mol·L-1 CaCl2溶液含有NA个Ca2+
C.48 g O3和O2的混合气体中含有3NA个O原子
D.1 mol NO2溶于水后溶液中含有NA个NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定体积的CO2通入到一定浓度的NaOH溶液中,为了测定其溶液的成分,向该溶液中逐滴加入1 mol/L盐酸。所加入盐酸的体积与产生二氧化碳气体体积(标准状况)的关系如图所示。
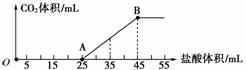
(1)写出OA段所发生反应的离子方程式:______________________________________ __________________________________________________________。
(2)当加入35 mL盐酸时,所产生的二氧化碳的体积(标准状况)是________mL。
(3)溶液中所含的物质有________________,其物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下面的式子是某同学书写的C5H12的同分异构体的结构简式:①CH2CH3CH2CH2CH3
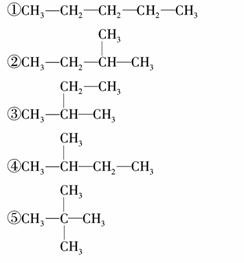
这些结构中出现重复的是( )
A.①② B.④⑤
C.②③④ D.均不重复
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究元素及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+ O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如右图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如右图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
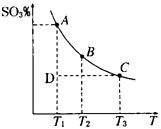
①2SO2(g) + O2(g) 2SO3(g)的△H____0(填“>”、“<”)。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”) 。
2SO3(g)的△H____0(填“>”、“<”)。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”) 。
②若温度为T1时,反应进行到状态D时,V正_______V逆(填“>”“<”或“=”)
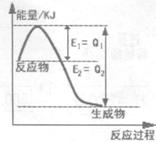
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产中有重要作用。
① 右图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式:(△H用含字母Q1、Q2的代数式表示) 。
②在AlCl3溶液中滴加氨水,反应的离子方程式为: 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25℃下,向0.1mol•L-1的NaCl溶液中逐滴加入适量的0.1mol•L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol•L-1的NaI溶液,看到的现象是 全品教学网, 用后离不了!,产生该现象的原因是(用离子方程式表示): 。
全品教学网, 用后离不了!(已知25℃时Ksp[AgCl] =1.0×10-10 mol2•L-2,Ksp[AgI] =1.5×10-16mol2•L-2 )
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理知识回答下列有关碳和碳的化合物的问题:
(1)汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
①请结合上表数据,写出NO与CO反应的化学方程式 .
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,根据表中数据计算K1= 。根据表中数据判断,温度T1和T2的关系是(填序号)__________。
A.T1>T2B.T1<T2 C.T1=T2 D.无法比较
(2)反应生成的气体E经常用氢氧化钠来吸收,现有0.4molE,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: .
(3)已知CH4、H2和CO的燃烧热分别为890.3kJ/mol,285.8 kJ/mol和283.0 kJ/mol,工业上利用天然气(主要成分是CH4)与CO2进行高温重整制备CO和H2,写出该反应的热化学方程式: .
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO为负极燃气,空气与CO2 的混合气为正极助燃气,制得在 650 ℃下工作的燃料电池,写出其负极和正极电极反应方程式:负极: ;正极: .
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学按如图所示的装置进行电解实验。下列说法不正确的是
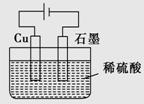
A.电解过程中,铜电极上有H2产生
B.电解初期,总反应方程式为Cu+H2SO4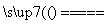 CuSO4+H2↑
CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,溶液pH值会增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com