
下列说法中不正确的是
A.光导纤维、硝化纤维、铜氨纤维、玻璃纤维的主成分都是糖类
B.生理盐水、葡萄糖注射液都不能产生丁达尔效应现象,不属于胶体
C.红外光谱仪可用于测定化合物的官能团、1H核磁共振仪可确定H所处的化学环境
D.用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可到达水果保鲜的目的
科目:高中化学 来源:2014高考名师推荐化学Ksp概念及简单应用(解析版) 题型:选择题
锅炉水垢是一种安全隐患,除去水垢中的CaSO4,可先用Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,而后用酸除去。下列说法不正确的是
A.CaCO3的溶解度小于CaSO4
B.沉淀转化的实质是沉淀溶解平衡的移动
C.沉淀转化的难易与溶解度差别的大小无关
D.CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:简答题
【化学与技术】
下图表示某些化工生产的流程(有的反应条件和产物已略去)

请回答下列问题:
(1)流程中所涉及的化学工业 (写出两个即可)。
(2)反应I需在500℃进行,主要原因是 ;实际工业生产中,反应Ⅱ的条件是 。
(3)写出反应III的化学方程式 。
(4)工业上,析出K后,再向母液中继续通入E,并加入细小食盐颗料,其目的是 。
(5)工业上常用Na2CO3溶液吸收制取HNO3产生的尾气中的NO2,生成NaNO3、NaNO2和一种气体,写出反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:简答题
硫的化合物在生产和科研中发挥着重要作用。
(1)SO2Cl2常用于制造医药品、染料、表面活性剂等。已知:SO2Cl2(g) SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____ kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____ kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
(2)工业上制备硫酸的过程中存在反应:2SO2(g)+O2(g) 2SO3(g) △H=-198kJ·mol-1,400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
2SO3(g) △H=-198kJ·mol-1,400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
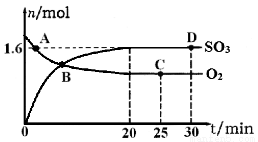
①0~20min反应的平均速率υ(O2)=___________。
②下列叙述正确的是 。
a.A点υ正(SO2)>υ逆(SO2)
b.B点处于平衡状态
c.C点和D点n(SO2)相同
d.其它条件不变,500℃时反应达平衡,n(SO3)比图中D点的值大
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,应更换吸收剂。此时溶液中c (SO32-)的浓度是0.2 mol·L-1,则溶液中c(HSO3-)是__mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:选择题
某离子反应中涉及H2O、ClO—、NH4+、H+、N2、Cl—六种微粒。其中N2的物质的量随时间变化的曲线如右图所示。下列判断正确的是:

A该反应的还原剂是Cl—
B消耗1 mol还原剂,转移6 mol电子
C氧化剂与还原剂的物质的量之比为2:3
D反应后溶液的酸性明显增强
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:选择题
已检测出pH=1的某未知溶液中含有Al3+和 ,若检验此溶液中是否大量存在以下6种离子:①ClO- ②
,若检验此溶液中是否大量存在以下6种离子:①ClO- ② ③Fe2+④K+ ⑤
③Fe2+④K+ ⑤ ⑥Cl-,其中不必检验就能加以否定的离子是
⑥Cl-,其中不必检验就能加以否定的离子是
A.①②⑥
B.②③④
C.①③⑤
D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:简答题
硫酸工业在国民经济中占有极其重要的地位。请回答硫酸工业中的如下问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 郊
区(填标号);
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)CuFeS2 是黄铁矿的另一成分,煅烧时CuFeS2 转化为CuO、Fe2O3和SO2,
该反应的化学方程式为 。
(3)为提高SO3吸收率,实际生产中通常用 吸收SO3。
(4)已知反应2SO2+O2 SO3 △H <0,现将0.050mol SO2和0.030mol O2
SO3 △H <0,现将0.050mol SO2和0.030mol O2
充入容积为1L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压
强缩小到原来压强的75%,则该条件下SO2的转化率为________;该条件下的
平衡常数为__________。
(5)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3 在
沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
已知CuSO4 在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随
温度升高而降低的原因 。
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方
法可用 (填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产
水泥的辅料,写出这两步反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:简答题
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图:
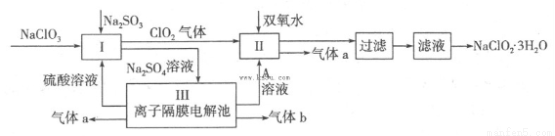
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出
NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | H2CO3 | H2S |
Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为 (用化学式表示);体积相等,物质的量浓度相同的NaF、NaClO2两溶液中所含阴阳离子总数的大小关系为: (填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是 ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为 。
(4)Ⅲ装置中生成气体a的电极反应式 ,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测2 题型:实验题
如图是一个制取氯气并以氯气为原料进行特定反应的装置。
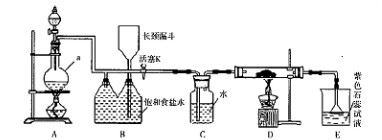
(l)A是氯气发生装置,写出其中的化学反应方程式 。
(2)a仪器的名称为 。
(3)实验开始时,先点燃A处的酒精灯,打开活塞K,让 氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HC1。写出D中反应的化学方程式 ,装置C的作用是 。
氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HC1。写出D中反应的化学方程式 ,装置C的作用是 。
(4)在E处,若漏斗内气体带有黄绿色,则紫色石蕊试液的颜色变化为 。
(5)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为 (填序号)。
①有白色沉淀生成;②无白色沉淀生成;③先生成白色沉淀,而后白色沉淀消失。
(6)D处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2
产生,则装置B中的现象是 ;若发现装置B中该现象不明显,可能的
原因是 ;查找原因时可用肥皂水或湿润的碘化钾淀粉试纸等,若用蘸
有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程
式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com