
| A. | CO2 | B. | N2 | C. | HCl | D. | O2 |
分析 先根据具有相同价电子数和相同原子数的分子或离子是等电子体,然后判断电子的数目来解答.
解答 解:A、二氧化碳是3原子,而一氧化碳是2原子,所以不是等电子体,故A错误;
B、N2的价电子数为5×2=10,而CO的电子数为4+6=10,都是双原子,所以两者是等电子体,故B正确;
C、氯化氢的价电子数是7+1=8,而CO的电子数为4+6=10,价电子数不等,所以不是等电子体,故C错误;
D、氧气的价电子数是6×2=12,而CO的电子数为4+6=10,价电子数不等,所以不是等电子体,故D错误;
故选B.
点评 本题主要考查了等电子体,解答本题的关键是要充分理解等电子体的本质特征,只有这样才能对问题做出正确的判断,题目难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:解答题
| 实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液完全褪色时间(s) | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||||
| ① | 0.20 | 2.0 | 0.010 | 4.0 | 2.0 | 25 | t1 |
| ② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
| ③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 50 | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒的氧化性比硫弱 | B. | 可以存在至少三种以上的化合价 | ||
| C. | SeO3对应水化物的酸性比HBrO4弱 | D. | 硒化氢的分子式为SeH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S的电子式: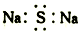 | B. | 二氧化硅的分子式:SiO2 | ||
| C. | 18O的原子结构示意图: | D. | HClO分子的结构式:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ①=②=③=④ | C. | ①=②=③>④ | D. | ①>②>③=④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{58}^{80}$Ce | B. | ${\;}_{58}^{138}$Ce | C. | ${\;}_{80}^{58}$Ce | D. | ${\;}_{80}^{138}$Ce |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
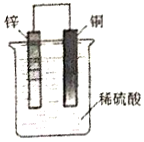
| A. | 铜片为电池的负极 | |
| B. | SO42-向负极移动 | |
| C. | 电子从铜片流向锌片 | |
| D. | 铜片上发生的电极反应为Cu-2e-═Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Na2O2既是氧化剂又是还原剂 | |
| B. | Na2FeO4既是氧化产物又是还原产物 | |
| C. | 1mol Na2O2发生反应,有2mol电子转移 | |
| D. | 在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com