

| A. | 硅原子最外层有4个电子 | |
| B. | 太阳能电池是一种化学电源 | |
| C. | 太阳能电池实现了光能向电能的转化 | |
| D. | B电极为电源正极 |
科目:高中化学 来源: 题型:选择题
| A. | 向MgCl2溶液中滴加过量氨水:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+4H++NO3-═Ag++NO↑+2H2O | |
| C. | 将Cu粉加入到Fe2(SO4)3溶液中:2Fe3++3Cu═2Fe+3Cu2+ | |
| D. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
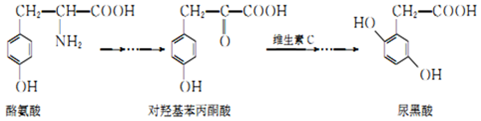
| A. | 酪氨酸既能与盐酸反应,又能与NaOH溶液反应 | |
| B. | 1mol尿黑酸与足量浓溴水反应,最多消耗3molBr2 | |
| C. | 对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个 | |
| D. | 对羟基苯丙酮酸分子核磁共振氢谱有4个峰,有1个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
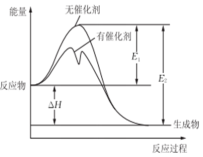 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能.下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能.下列有关叙述正确的是( )| A. | 该反应为吸热反应 | |
| B. | E1-E2=△H | |
| C. | 升高温度,不会提高活化分子的百分数 | |
| D. | 使用催化剂使该反应的化学平衡常数发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
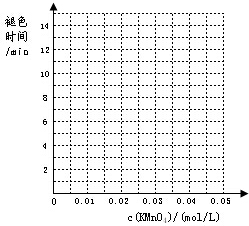 草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
| 实验组别 | c(H2C2O4) /(mol/L) | V(H2C2O4) /ml | c(KMnO4) /(mol/L) | V(KMnO4) /ml | c(H2SO4) /(mol/L) | 褪色所需时间 | 实验 目的 |
| 1 | 0.2 | 2 | 0.0025 | 4 | 0.12 | 6′55″ | (a)探究KMnO4溶液浓度对化学反应速率的影响 |
| 0.2 | 2 | 0.005 | 4 | 0.12 | 5′17″ | ||
| 0.2 | 2 | 0.01 | 4 | 0.12 | 3′20″ | ||
| 0.2 | 2 | 0.02 | 4 | 0.12 | 9′05″ | ||
| 0.2 | 2 | 0.03 | 4 | 0.12 | 11′33″ | ||
| 0.2 | 2 | 0.04 | 4 | 0.12 | 14′20″ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;若反应中生成0.2mol HNO3,转移的电子数目为0.4NA个.
;若反应中生成0.2mol HNO3,转移的电子数目为0.4NA个.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 0.3mol | C. | 0.2mol | D. | 0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| B. | H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=+114.6 kJ•mol-1 | |
| C. | $\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=+57.3 kJ•mol-1 | |
| D. | $\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
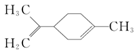 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )| A. | 它在核磁共振氢谱中有6个峰 | B. | 它能发生取代、加成和氧化反应 | ||
| C. | 它与丁基苯互为同分异构体 | D. | 它属于芳香族化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com